КРОВЬ И ЕЕ КОМПОНЕНТЫ
Методы исследования компонентов крови
Кровь представляет собой жидкость сложного состава — плазму, в которой суспензированы форменные элементы: эритроциты (RBC), лейкоциты (WBC) и тромбоциты (PLT). При коагуляции крови после отделения сгустка остается жидкость, которая называется сывороткой. Из методов количественного и качественного исследования форменных элементов крови наиболее распространен общеклинический анализ крови: определение концентрации гемоглобина, цветового показателя, содержания эритроцитов, лейкоцитов, лейкоцитарной формулы, описание особенностей морфологической картины клеток крови, оценка скорости оседания эритроцитов. Дополнительно определяют количество ретикулоцитов и тромбоцитов. Эти исследования проводят всем стационарным больным и по показаниям — амбулаторным. Нередко ограничиваются недостаточно информативным определением количества гемоглобина, лейкоцитов и СОЭ (так называемая «тройка»).
Взятие и обработка крови
Исследование рекомендуется проводить утром натощак или через 1 час после легкого завтрака. Кровь для проведения общего клинического анализа берут у пациента из пальца, вены или из мочки уха, а у новорожденных — из пятки. Не рекомендуется брать кровь после физической и умственной нагрузки, применения медикаментов, особенно при внутривенном или внутримышечном их введении, воздействия рентгеновских лучей и после физиотерапевтических процедур. В экстренных случаях этими правилами пренебрегают.
Реактивы:
5%-ный раствор трехзамещенного цитрата натрия, хранят 1–2 недели, при помутнении негоден.
Трансформирующий раствор.
Изотонический раствор (0,9%) натрия хлорида.
3–5%-ный раствор уксусной кислоты.
Спирт.
Оборудование:
Стерильные скарификаторы.
Пробирки.
Мерные пипетки объемом 20 мкл.
Капилляры от аппарата Панченкова.
Дозаторы или мерные пипетки объемом 1 мл и 5 мл.
Предметные стекла.
Шлифовальные стекла для приготовления мазков крови.
Взятие капиллярной крови. Капиллярную кровь получают с помощью прокола: 1 - мякоти концевых фаланг пальцев рук, 2- мочки уха, 3 - у новорожденных — пятки или большого пальца ноги. Прокол должен быть глубокий, около 3-4 мм. Не следует брать кровь из воспаленных или поврежденных участков. Если место предполагаемого прокола холодное или цианотическое, его предварительно согревают массированием или погружением конечности в теплую воду. Кожу обрабатывают семидесятипроцентнымэтиловым спиртом и затем прокалывают. Первую каплю снимают ватным тампоном. Из следующих капель крови при легком надавливании быстро набирают необходимое количество крови. Кровь с поверхности пальца набирается индивидуальным стерильным капилляром Панченкова.
Заранее наливают в пробирки соответствующие реактивы: для определения СОЭ — в капилляр Панченкова набирают 25 мкл (до метки 75) реактива 1; для определения концентрации гемоглобина — 5 мл реактива 2; для подсчета числа эритроцитов — 4 мл реактива 3; для подсчета числа лейкоцитов — 0,4 мл реактива 4.
Обработка крови. Обработку крови начинают с разведения для определения СОЭ, так как для этого исследования требуется наибольшее количество крови. Для определения СОЭ в капилляр, промытый в реактиве 1, набирают кровь до метки 0 (100 делений) и выдувают ее в пробирку с раствором цитрата натрия (соотношение при этом крови и реактива 4:1). Затем разводят кровь для подсчета количества эритроцитов. Для подсчета количества эритроцитов кровь объемом 20 мкл выдувают на дно пробирки с реактивом 3 и промывают пипетку несколько раз в верхнем слое жидкости (разведение 1:200). Для определения концентрации гемоглобина 20 мкл крови выдувают на дно пробирки с реактивом 2 и промывают капилляр сали несколько раз в верхнем слое жидкости (разведение 1:251). Для подсчета количества лейкоцитов кровь объемом 20 мкл выдувают на дно пробирки с реактивом 4 и промывают капилляр несколько раз в верхнем слое жидкости (разведение 1:20). Для исследования лейкоцитарной формулы, морфологии эритроцитов, лейкоцитов, тромбоцитов готовят препараты. Наносят каплю крови на сухое обезжиренное предметное стекло и быстро готовят тонкие мазки с помощью шлифовального стекла.
В настоящее время в связи с появлением гематологических анализаторов стали шире использовать для общего клинического анализа венозную кровь, которую берут либо в специальные пластиковые пробирки одноразового использования с порошком ЭДТА, либо в стеклянные пробирки с другим антикоагулянтом. Сразу после взятия крови пробирку закрывают пробкой и несколько раз тщательно перемешивают кровь, не взбалтывая, что позволяет избежать образования сгустков, наличия которых искажает результаты.
Гемоглобин
Гемоглобин (HB) — основной дыхательный пигмент эритроцитов, относящийся к хромопротеидам и обеспечивающий ткани кислородом; состоит из белка — глобина и гема — соединения протопорфирина IХ с железом. Последний придает гемоглобину характерную окраску. Присоединение к гему различных химических групп сопровождается изменением окраски, на этом основано и определение концентрации гемоглобина в крови.
Исследование содержания гемоглобина в крови (гемоглобинометрия) включает определение гемоглобина и его дериватов, которые присутствуют в крови здоровых людей или появляются при различных патологических состояниях. У здоровых людей гемоглобин в крови находится главным образом в виде оксигемоглобина, восстановленного гемоглобина и в небольшом количестве — меттемоглобина, карбоксигемоглобина и вердоглобина.
Унифицированная гемиглобинцианидная методика определения гемоглобина. Принцип. Гемоглобин окисляют в метгемоглобин (гемиглобин) железосинеродистым калием (красная кровяная соль). Метгемоглобин, вступая в реакцию с ацетонциангидрином, образует окрашенный цианметгемоглобин (гемиглобинцианид), интенсивность окраски которого пропорциональна содержанию гемоглобина.
Реактивы. Трансформирующий раствор: ацетон-циангидрин — 0,5 мг; калий железосинеродистый — 0,2 г; натрия гидрокарбонат — 1 г; дистиллированная вода — до 1 л. Раствор желтого цвета, прозрачный. При обесцвечивании или появлении осадка непригоден. Стабилен в течение нескольких месяцев при хранении в посуде из темного стекла при комнатной температуре.
Стандартный калибровочный раствор гемиглобинцианида промышленного изготовления (НПО «Ренам», ЗАО «Медлакор», «Лахема»). Точные значения концентрации гемиглобинцианида и гемоглобина для каждой серии указаны в паспорте набора.
Специальное оборудование. Фотоэлектроколориметр (КФК-2, КФК-2 МП, КФК-3) спектрофотометр или гемоглобинометр любой марки («Мини Гем 540»).
Ход определения. В пробирку к 5 мл трансформирующего раствора добавляют 20 мкл крови (разведение 1:251). Содержимое пробирки тщательно перемешивают и оставляют стоять на 10 мин. Измеряют на фотоколориметре при длине волны 540 нм (для СФ) или 520–560 нм (зеленый светофильтр для ФЭК) в кювете длиной оптического пути 1 см против холостой пробы (трансформирующий раствор).
Расчет содержания гемоглобина. Расчет содержания гемоглобина производят по калибровочному графику, построенному по 4 точкам. На миллиметровой бумаге по горизонтальной оси абцисс откладывают концентрации гемоглобина в г/л, указанные в паспорте и соответствующие содержанию гемиглобинцианида в ампулах. На вертикальной оси ординат откладывают величину экстинкции или показания гемоглобинометра, полученные при измерении соответствующего раствора гемиглобинцианида. Калибровочный график должен представлять собой прямую линию, исходящую из начала координат. Получение кривой линии вместо прямой означает, что в работе были допущены ошибки, или прибор неисправен. Из калибровочного графика, построенного для данного прибора, рассчитывают фактор, который используется для программируемого фотометра или при расчете таблицы.
Определение гемоглобина гематологическими анализаторами также основано на методе колориметрии. Ход исследования осуществляется согласно инструкции к набору реактивов.
Нормальные величины. У здоровых людей концентрация гемоглобина в крови составляет:
мужчины 132–164 г/л,
женщины 115–145 г/л,
новорожденные 135–195 г/л,
дети 1 год — 110–130 г/л,
дети 10–12 лет — 115–145 г/л.
Дневные колебания: значения гемоглобина минимальны утром и максимальны вечером.
Клиническое значение. Снижение концентрации гемоглобина в крови является основным лабораторным симптомом анемии. При этом содержание гемоглобина варьирует в широких пределах в зависимости от формы анемии и ее степени. Следует, однако, иметь в виду, что диагностика анемии ни в коей мере не может быть проведена лишь на основании определения концентрации гемоглобина в крови. Это исследование устанавливает только факт наличия анемии. Для уточнения ее характера необходимо исследование количества эритроцитов, цветового показателя, других расчетных индексов эритроцитов, морфологии эритроцитов.
Повышение концентрации гемоглобина в крови может наблюдаться при миелопролиферативных заболеваниях и симптоматических эритроцитозах, сопутствующих различным состояниям. Среди миелопролиферативных заболеваний наиболее характерно повышение гемоглобина при эритремии. Симптоматические реактивные эритроцитозы могут быть абсолютными (обусловлены пролиферацией элементов эритропоэза) и относительными (гемоконцентрационные). Физиологическое увеличение содержания гемоглобина свойственно новорожденным.
Фракции гемоглобина. Существуют физиологические и патологические виды гемоглобина. К физиологичесим относят три основных типа гемоглобина: примитивный — Р; фетальный — F; взрослый — А. Помимо физиологических, выделено более 200 форм патологических гемоглобинов, отличающихся друг от друга физико-химическими свойствами, в частности, различной электрофоретической подвижностью и разным отношением к щелочам. Среди гемоглобинопатий наиболее известна гемоглобинопатия S — серповидно-клеточная анемия. Одним из наиболее широко распространенных методов, позволяющих выявить патологические гемоглобины, является электрофоретический метод исследования. Исследование патологических гемоглобинов является трудоемким и проводится в специализированных лабораториях.
Эритроциты — наиболее многочисленная популяция клеток. В кровеносном русле при нормальных физиологических условиях эритроцит имеет форму двояковогнутого диска. Сухое вещество эритроцита содержит около 95 % гемоглобина, остальные 5 % приходятся на долю других белков, липидов, ферментов. Основная функция эритроцитов — снабжение тканей кислородом и транспорт углекислого газа. Они участвуют в поддержании буферного ионно-водного равновесия, взаимодействуют с циркулирующими иммунными комплексами за счет Fс-рецепторов клеточной мембраны, обладают антигенными свойствами. Продолжительность жизни эритроцитов — 100–120 дней, разрушаются они макрофагами селезенки.
Подсчет количества. Подсчет эритроцитов в крови осуществляется двумя методами — в счетной камере и гематологическом анализаторе.
Унифицированный метод подсчета в счетной камере. Подсчет эритроцитов под микроскопом в определенном количестве квадратов счетной сетки и пересчет на 1 мкл крови, исходя из объема квадратов и разведения крови.
Реактивы. 0,9%-ный раствор хлорида натрия.
Специальное оборудование: Счетная камера Горяева. Микроскоп.
Ход исследования. Исследуемую кровь разводят в 200 раз. Для этого в сухую пробирку отмеривают 4 мл реактива 1. Пипеткой набирают 20 мкл крови. Кончик пипетки вытирают фильтровальной бумагой или марлей и кровь выдувают на дно пробирки с реактивом 1, пипетку тщательно промывают в верхнем слое жидкости, повторно набирая ее и выдувая в пробирку, содержимое пробирки перемешивают и оставляют стоять до момента счета (рекомендуется считать эритроциты в течение ближайших 2–3 часов после взятия крови, а при гемолитических и B12 дефицитной анемии — сразу после взятия, так как эритроциты могут разрушиться).
Подготавливают счетную камеру: протирают насухо камеру с сеткой и покровное стекло, затем покровное стекло притирают к камере, слегка надавливая на него таким образом, чтобы по краям его появились радужные полосы (это свидетельствует о требуемой высоте камеры — 0,1 мм). Заполняют счетную камеру разведенной кровью: предварительно несколько раз тщательно встряхивают содержимое пробирки, затем пастеровской пипеткой или стеклянной палочкой отбирают каплю разведенной крови и подносят ее к краю покровного стекла, следя за тем, чтобы она равномерно без пузырьков воздуха заполнила всю поверхность камеры с сеткой, не затекая в бороздки. Заполненную камеру оставляют в горизонтальном положении на 1 мин. (для оседания эритроцитов).
Для подсчета эритроцитов, не меняя горизонтального положения камеры, помещают ее на столик микроскопа и с помощью малого увеличения микроскопа (объектив 8х, окуляр 10х) находят верхний левый край сетки (для лучшего контрастирования следует опустить конденсор и прикрыть диафрагму). Счет производят в 5 больших квадратах, разделенных на 16 малых, т. е. в 80 малых квадратах. Рекомендуется считать клетки в квадратах сетки, расположенных по диагонали. Для того чтобы одни и те же эритроциты, лежащие на линиях, не попали дважды в счет, принято для каждого квадрата, кроме элементов, лежащих внутри квадрата, считать расположенные на определенных двух линиях (например, на левой и верхней).
Расчет количества эритроцитов в 1 мкл крови производят, исходя из разведения крови (200), числа сосчитанных квадратов (80) и объема 1 малого квадрата (1/4000 мкл).
Причины ошибок при подсчете эритроцитов:
Неточность при взятии крови в пипетку.
Неудовлетворительная градуировка пипеток.
Образование сгустка крови.
Неправильное притирание покровного стекла камеры или недостаточная его толщина (менее 0,3 мм).
Подсчет производят сразу после заполнения камеры, когда клетки еще не успели осесть на дно.
Плохо вымытые и недостаточно высушенные пипетки и пробирки.
Недоброкачественность реактивов, вызывающих гемолиз.
Любое отклонение от правил подготовки камеры, ее заполнения и подсчета клеток.
Метод автоматического подсчета эритроцитов с помощью счетчиков и гематологических анализаторов облегчает выполнение этого исследования и делает его более производительным.
Унифицированная методика автоматического подсчета эритроцитов. При работе с гематологическими счетчиками подготовка пробы (разведение) осуществляется вручную. При использовании гематологических анализаторов отбор пробы крови и ее обработка происходят без участия лаборанта.
Принцип работы. Принцип работы большинства анализаторов основан на кондуктометрическом методе: определенное количество разведенной изотоническим раствором натрия хлорида или другого электролита крови пропускается через микроотверстие, проходящая через него клетка увеличивает сопротивление между электродами, и возникающий импульс передается на счетное устройство с цифровой индикацией.
Ход исследования. Ход исследования выполняется в соответствии с инструкцией, прилагаемой к анализатору.
Нормальные величины. Количество эритроцитов в крови здорового человека составляет, по данным А.И. Воробьева, у мужчин — 4,0 х 1012/л — 5,1 х 1012/л, у женщин — 3,7 х 1012/л — 4,7 х 1012/л.
Клиническое значение. Снижение количества эритроцитов (эритроцитопения) является одним из основных критериев анемического синдрома. От истинный анемии необходимо отличать гидремию, связанную с увеличением объема плазмы за счет притока тканевой жидкости. Причинами анемии являются кровопотери, нарушения кроветворения в костном мозге и повышенный гемолиз. Кроме того, уменьшение количества эритроцитов имеет место при лейкозах, множественной миеломе, неходжкинских лимфомах, системной красной волчанке, ревматоидном артрите, метастазах злокачественных опухолей и др. Уменьшение количества эритроцитов наблюдается также при недостаточном содержании белка в пище, голодании, вегетарианской диете. Увеличение количества эритроцитов в единице объема крови называется полиглобулией или эритроцитозом.
Исследование морфологии эритроцитов. В клинической практике морфологию эритроцитов обычно исследуют в окрашенных мазках крови. Унифицированная методика приготовления мазков крови.Подготовка стекол.Реактивы: Хозяйственное мыло — 2%-ный раствор или раствор стирального порошка: 20 г растворить в 975 мл воды и добавить 20 мл пергидроля. Смесь Никифорова: равные части этилового спирта 96°-го и диэтилового эфира.
Ход обработки стекол. Стекла (новые и бывшие в употреблении) помещают в эмалированную посуду с реактивом 1 на 8–10 час. Кипятят в указанном растворе 10–15 мин., старые мазки предварительно стирают ветошью или ватным тампоном. Более длительное кипячение или использование алюминиевой посуды не рекомендуют, так как стекла мутнеют. Промывают в проточной воде, вытирают и помещают в смесь Никифорова на 60 мин., затем вытирают насухо. Чистые стекла рекомендуется брать либо пинцетом, либо за края (соприкосновение пальцев с поверхностью стекла оставляет жирные следы). Для стерилизации упаковывают по 2 стекла в индивидуальный набор на каждого больного. Стерилизуют сухим жаром в течение 1 час при 180°С.
Техника приготовления мазков. На сухое, подготовленное описанным выше способом предметное стекло наносят мазок крови следующим образом. На стекло ближе к короткой стороне, отступая 1,5 см от края, наносят стеклянной палочкой (или непосредственно из места укола) небольшую каплю крови. Оставляют стекло в горизонтальном положении и размазывают каплю крови по стеклу с помощью чистого шлифованного стекла, помещая его под уголом 45° коротким ребром; подождав, пока вся кровь расплывется по нему, быстро проводят по предметному стеклу. Не следует сильно нажимать на стекло, так как при этом сильно травмируются форменные элементы крови. Мазки высушивают на воздухе и маркируют (лучше простым карандашом). Высохший мазок должен быть равномерно тонким, желтоватого цвета, достаточной величины (располагаться на 1,0–1,5 см от краев, занимать почти всю длину стекла) и оканчиваться «метелочкой». Толстые (густо-розового цвета) мазки не следует использовать, так как в них морфология клеток плохо различима. Стандартные качественные мазки получаются при использовании автоматических устройств, предназначенных для приготовления мазков, выпускаемых различными фирмами.
Фиксация и окраска мазков. Реактивы для фиксации: метиловый спирт х.ч. или раствор эозинметиленового синего по Маю-Грюнвальду. Фиксация предотвращает попадание воды в клетки и изменение их морфологии. Фиксация мазков. Фиксатор мазков наливают либо в кювету, либо в широкогорлую посуду с притертой пробкой. Высушенные на воздухе мазки помещают в контейнер, который опускают в кювету с фиксатором (или кладут по одному в посуду) на 5–10 минут. Вынимают контейнер со стеклами из кюветы (или вынимают пинцетом стекла и устанавливают в штативе), оставляют на воздухе до полного высыхания.
Реактивы для окраски мазков по Нохту. Основной раствор азура II: 1 г краски растворяют в 1 мл дистиллированнной воды. Оставляют на 12–14 дней в посуде из темного стекла при комнатной температуре, после чего используют.
Основной раствор эозина калия: 1 г краски растворяют в 1 л дистиллированной воды. Оставляют в посуде из темного стекла при комнатной температуре на 12–14 дней, затем используют.
Фосфатный буфер (смесь Вейзе)с pH 7,4–7,5: смешивают 0,49 г калия фосфата однозамещенного безводного (KH2PO4) и 0,909 г натрия фосфата двузамещенного безводного (Na2HPO4) и дистиллированной воды 1 л.
Рабочий раствор азур-эозина: перед употреблением смешивают 25 мл основного раствора азура II, 20 мл основного раствора (пропорции красителей могут варьировать, их устанавливают опытным путем при приготовлении свежих партий основных растворов).
Реактивы для окраски мазков по Паппенгейму. Раствор эозин-метиленового синего по Маю-Грюнвальду. При отсутствии готового раствора красителя его можно приготовить, растворив 1 г сухого красителя в 1 л метилового спирта. Раствор готов к употреблению через 4 дня.
Рабочий раствор азур-эозина по Нохту.
Реактивы для окраски мазков по Романовскому-Гимзе. Краска Романовского-Гимзы заводского приготовления имеет следующий состав: азур II — 3 г; водорастворимый эозин — 0,8 г; метиловый спирт — 250 мл; глицерин — 250 мл.
Краска Романовского-Гимзы сухая: 3,8 г сухой краски растворяют в 250 мл метилового спирта (или этилового), оставляют на 3 дня. Затем добавляют 250 мл глицерина и снова оставляют на 3–5 суток, периодически взбалтывая. Краску фильтруют. Хранится в темной посуде. Готовый раствор Романовского-Гимзы перед употреблением разводят из расчета: 1 капля краски на 1 мл нейтральной дистиллированной воды или буферного раствора.
Специальное оборудование. Кювета для фиксации и окрашивания мазков со штативом-контейнером (при отсутствии используют эмалированные мойки с установленными для стекол «рельсами» из пары стеклянных палочек, соединенных резиновыми трубками).
Окраска по Нохту. Высохшие фиксированные мазки, не вынимая из контейнера, помещают в кювету с рабочим раствором краски на строго определенное время, подобранное для каждой партии красителя (от 30 до 45 мин.). При отсутствии кюветы с контейнером стекла помещают горизонтально на «рельсы» (мазком кверху) и наливают высокий слой (3–4 мл на мазок) рабочего раствора краски. Вынимают контейнер со стеклами из кюветы с красителем и помещают его в кювету с водопроводной водой. Высушивают мазки на воздухе.
Окраска по Паппенгейму. Сухие нефиксированные мазки помещают в кювету с раствором Мая-Грюнвальда на 3–5 минут (или наливают на мазок, помещенный на «рельсы», раствор высоким слоем). Контейнер с мазками ополаскивают в кювете с дистиллированной водой (или на мазок, помещенный на «рельсы», не смывая краситель, добавляют дистиллированную воду на 1 мин.). Помещают контейнер с мазками в кювету с азур-эозиновой краской по Нохту (или наливают на мазок краску) на 8–15 минут. Смывают краску водопроводной водой. Мазки высушивают на воздухе.
Окраска по Романовскому-Гимзе производится так же, как и по Нохту: в качестве красителя используют готовый раствор Романовского-Гимзы. Время окраски устанавливают опытным путем для каждой новой партии красителя (25–40 минут).
Автоматическая фиксация и окраска мазков может быть осуществлена с помощью специальных устройств, в которые ручным способом загружают нефиксированные мазки. Последующее автоматическое дозирование фиксатора-красителя и буферных растворов обеспечивает стандартную и равномерную окраску мазков.
Анализ морфологии эритроцитов. Принцип. Исследование окрашенных мазков крови с помощью иммерсионной системы микроскопа.
Реактивы: Иммерсионное масло. Диэтиловый эфир.

Морфология клеток эритроцитного ряда: а) эритробласт; б) пронормоцит; в) базофильный нормоцит; г) полихроматофильный нормоцит; д) оксифильный нормоцит; е) рекулоциты; ж) эритроциты.
Морфология клеток эритроидного ряда. Ход исследования. Предметное стекло с окрашенным и высохшим мазком крови помещают на столик микроскопа и с помощью малого увеличения (окуляр 7х, объектив 8х) находят край мазка. Не меняя положения стекла, наносят каплю иммерсионного масла на край мазка, на место, расположенное под объективом. Переводят иммерсионный объектив в вертикальное по отношению к мазку положение, при этом объектив погружается в каплю масла. Осторожно с помощью макровинта добиваются получения изображения в поле зрения микроскопа. Затем с помощью микровинта устанавливают четкую видимость препарата.
Критерием правильно подобранного для каждого глаза фокусного расстояния будет ясное изображение клеток с четкими границами и внутриклеточной структурой. После этого приступают к изучению морфологии эритроцитов, обращая внимание на их форму, размеры, интенсивность окраски, наличие патологических форм, внутриклеточных включений и т. п. Поскольку клетки имеют определенный объем, для лучшего их рассмотрения необходимо постоянно менять с помощью микровинта фокусное расстояние. Для получения более полного представления о морфологии клеток необходимо просматривать несколько полей зрения, передвигая мазок. Изучать морфологию эритроцитов нужно в тонких участках мазка, где они располагаются одиночно, не образуя так называемых «монетных столбиков», обычно на краю мазка вблизи краевой «метелки».
По окончании микроскопии с помощью макровинта поднимают тубус микроскопа, снимают мазок с предметного столика, стирают иммерсионное масло с объектива и предметного стекла марлей, смоченной эфиром. У здоровых людей эритроциты имеют примерно одинаковый размер. Для более точного предст давления о размере клеток проводят эритроцитометрию — измерение диаметра эритроцитов. Эритроцит имеет форму двояковогнутого диска с утолщением по краям. В окрашенных препаратах эритроциты имеют форму диска с небольшим просветлением в центре. Оксифилия (способность воспринимать кислые красители) клетки обусловлена присутствием гемоглобина, поэтому по интенсивности окраски можно судить о степени насыщения эритроцитов гемоглобином.
Картина крови при перпициозной анемии.
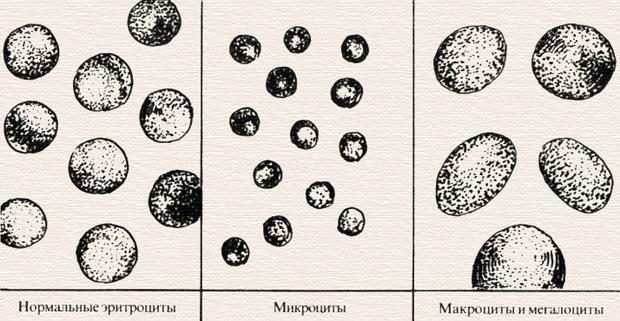
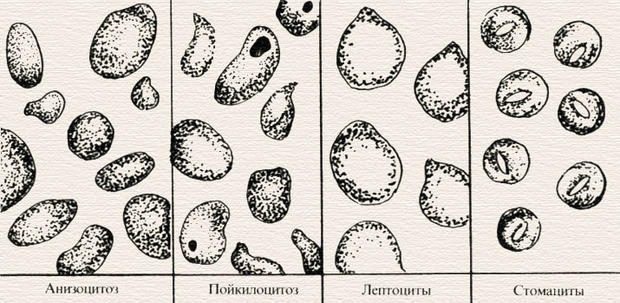
Клиническое значение. Изменение морфологии эритроцитов в виде появления эритроцитов разного размера (анизоцитоз), разной формы (пойкилоцитоз), разной окраски (анизохромия) являются важными морфологическими симптомами различных форм анемии. Анизоцитоз — наличие в крови эритроцитов разного размера. Микроцитоз — это состояние, когда 30–50 % от общего числа эритроцитов составляют микроциты (эритроциты, диаметр которых меньше 6,5 мкм). Макроцитоз — это состояние, когда 50% и более от общего числа эритроцитов составляют макроциты (эритроциты, диаметр которых более 8 мкм). Мегалоцитоз — это состояние, когда 50% от общего числа эритроцитов составляют мегалоциты (эритроциты, диаметр которых более 9,5 мкм).
Картина крови при перпициозной анемии.
Нормальная величина эритроцитов 7,55±0,01 мкм. Выделяют три степени анизоцитоза: 1 (или +) — 50% эритроцитов в поле зрения представлены клетками разного размера (микро- или макроцитами); 2 (++) — 75% эритроцитов в поле зрения представлены клетками разного размера; 3 (+++) — более 75% эритроцитов в поле зрения представлены клетками разного размера. Наличие эритроцитов разной формы называют пойкилоцитозом. Описаны следующие патологические формы эритроцитов:
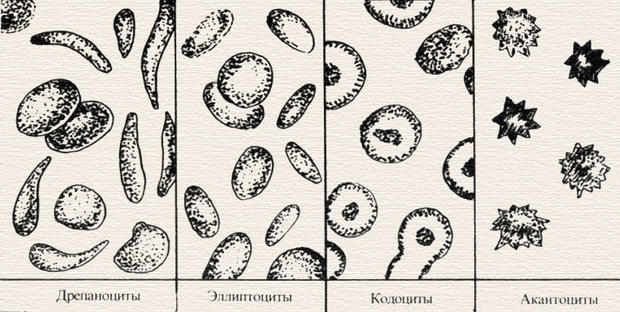
микросфероциты (шаровидные эритроциты с увеличенной толщиной и уменьшенным диаметром без просветления в центре), являющиеся патогномоничным признаком наследственной гемолитической микросфероцитарной анемии;
овалоциты или эллиптоциты (до 10% встречаются у здоровых людей); у больных наследственным эллипоцитозом составляют 25–75% от общего числа эритроцитов;
мишеневидные эритроциты (с окрашенным участком в центре клетки на фоне неокрашенной зоны) часто встречаются при талассемии, при железодефицитных анемиях;
шизоциты (мелкие фрагменты величиной 2–3 мкм);
акантоциты (эритроциты с зазубренным краем);
дрепаноциты (эритроциты серповидной формы), встречающиеся при серповидно-клеточной анемии;
планоциты или лентоциты (плоские эритроциты).
Картина крови при перпициозной анемии.
Выделяют четыре степени пойкицитоза:
0 — в поле зрения менее 10% эритроцитов разной формы,
+ — в поле зрения 10–25% эритроцитов разной формы,
++ — в поле зрения до 50% эритроцитов разной формы,
+++ — в поле зрения более 50% эритроцитов разной формы.
Окраска эритроцитов. Эритроциты окрашиваются кислыми красителями в розовато-красный цвет. Степень оксифилии клетки обусловлена присутствием гемоглобина и его количеством. Эритроциты здоровых людей имеют равномерную окраску и небольшое просветление в центре (нормохромия). Бледная окраска эритроцитов с широкой неокрашенной центральной частью называется гипохромией. Гипохромия эритроцитов обусловлена низким содержанием гемоглобина эритроцитах и чаще характерна для дефицита железа, но также имеет место при свинцовом отравлении, талассемии. Гипохромия обычно сочетается с микроцитозом. Выделяют три степени гипохромии:
+ — просветление в центре несколько больше нормы;
++ — окрашенная часть представлена в виде узкой ленты;
+++ — окрашенная часть представлена в виде очень узкого кольца.
Усиленная окраска эритроцитов называется гиперхромией, обусловлена увеличением объема эритроцитов и обычно сочетается с макро- и мегалоцитозом. Анизохромия — различная интенсивность окрашивания отдельных эритроцитов или участков одного эритроцита, часто встречается при железодефицитной анемии. Полихроматофилия — недостаточное накопление гемоглобина в эритроцитах с остатками базофильной субстанции. Незрелый эритроцит воспринимает и кислую, и щелочную краску и окрашивается в цвет от синего до серовато-розового. В норме встречаются единичные полихроматофильные эритроциты. Число их может увеличиваться при усиленном эритропоэзе постгеморрагические, гемолитические анемии). Выделяют три степени полихромазии:
Р+ — единичные полихроматофилы через каждые 2–3 поля зрения;
Р++ — 1–4 полихроматофила в каждом поле зрения;
Р+++ — более 10 полихлорматофилов в каждом поле зрения.
При морфологическом исследовании эритроцитов необходимо определить наличие в мазке патологических форм эритроцитов или включений в эритроцитах. Эритроциты с ядром — нормобласты, эритробласты — встречаются при самых разнообразных состояниях. Наиболее высокая степень содержания нормобластов имеет место при гемолитической анемии в момент гемолитического криза, при хроническом миелофиброзе, метастазах злокачественных опухолей в костный мозг.
Включения. При B12-дефицитной анемии и после спленэктомии встречаются эритроциты с остатками ядер в виде колец Кебота, телец Жолли, пылинок Вейденрейха. Тельца Жолли — остатки ядерного хроматина округлой формы, размером 1 мкм и более в количестве от 1 до 3 в эритроците, красно-фиолетового цвета. Кольца Кебота — остатки ядерной оболочки в виде тонких, нитеобразных колечек, окрашенных в красный цвет. Пылинки Вейденрейха — остатки ядерного вещества розового, иногда голубого цвета, встречаются при тяжелых анемиях, главным образом — мегалообластных. Тельца Гейнца-Эрлиха представляют собой обычно одно круглое включение (реже 2–3) размером 1–2 мкм, располагающееся по периферии эритроцита. При обычной окраске по Романовскому они не видны. Определяют их по методике Дейге с метиловым фиолетовым. Тельца при этом окрашиваются в пурпурно-красный цвет. Появление телец Гейнца-Эрлиха является доказательством тяжелого токсического повреждения веществами, окисляющими гемоглобин (нитробензол, анилин, нитроглицерин, сульфаниламидные препараты), и приводящими к гемолизу.
Эритроцитометрия (измерение диаметра эритроцитов). Унифицированная микроскопическая методика измерения диаметра эритроцитов с помощью окуляр-микрометра в окрашенном мазке крови. Специальное оборудование: Микроскоп. Окуляр-микрометр — окуляр, насаживаемый на тубус микроскопа, с круглой стеклянной платинкой и нанесенной на нее шкалой, разделенной на 50 делений. Объект-микрометр — предметное стекло со шкалой длиной 2 мм, разделенной на 200 делений, каждое из которых равно 10 мкм.Ход определения. Перед началом работы определяют цену одного деления шкалы окуляр-микрометра, которая зависит от длины тубуса микроскопа и увеличения объектива. Определение проводят с помощью объект-микрометра, который устанавливают на столик микроскопа так, чтобы шкалы окуляр-микрометра и объект-микрометра совпали. Затем отсчитывают число делений шкалы окуляр-микрометра, совпадающих с тем или иным количеством делений шкалы объект-микрометра, и определяют цену деления. Например, 40 делений шкалы окуляр-микрометра совпали с 7 делениями объект-микрометра, что сооответствует 60 мкм, т. е. одно деление окуляр-микрометра будет равно: 60:40=1,5 мкм. Это определение проводят один раз для определенного микроскопа, на котором в дальнейшем проводят эритроцитометрию.
В тонком мазке крови с помощью иммерсионной системы микроскопа с максимально освещенным полем зрения измеряют диаметр не менее 100 эритроцитов. Отмечают результат измерения каждого эритроцита. Зная цену деления и количество эритроцитов с одинаковым числом делений, выражают результат в процентах.
Пример. Эритроциты с диаметром 4,5 мкм — 5%, 6,0 мкм — 10%, 7,5 мкм — 70%, 9,0 мкм — 11%, 10,5 мкм — 4%. Результат можно представить в виде эритроцитометрической кривой (кривая Прайс-Джонса), при этом по оси абцисс откладывают размеры эритроцитов, а по оси ординат — количество эритроцитов данного размера. В рутинной практике кривой Прайс-Джонса пользуются редко в связи с большой трудоемкостью ее выполнения. Современные гематологические анализаторы вычерчивают кривую Прайс-Джонса автоматически. При необходимости результат выражают в виде среднего размера эритроцита.
Клиническое значение. Сдвиг эритроцитометрической кривой влево чаще имеет место при железодефицитных анемиях, микросфероцитозе, талассемии, свинцовом отравлении. Сдвиг эритроцитометрической кривой вправо наблюдается при B12 и фолиеводефицитной анемиях, алкоголизме, диффузных поражениях печени.
Общий обем эритроцитов (гематокритная величина). Гематокритная величина, или показатель гематокрита, дает представление о соотношении между объемами плазмы и форменных элементов крови (главным образом — эритроцитов), полученном после центрифугирования крови. Принято гематокритной величиной выражать объем эритроцитов.
Метод определения гематокрита с помощью микроцентрифуг. Принцип. Центрифугирование цельной крови определенное время при постоянном числе оборотов центрифуги с последующим определением результата по специальной шкале.
Реактивы. Антикоагулянты: гепарин — 5 000 ед/мл разводят дистиллированной водой в соотношении 1:5 или этилен-диаминтетрауксусной кислоты динатриеваю соль (NA2-ЭДТА, трилон Б), 40 г/л.
Оборудование. Микроцентрифуга гематокритная любой марки. Капиллярные трубки (в комплекте с центрифугой). Можно использовать капилляры для определения С-реактивного белка.
Ход определения. Предварительно обработанный антикоагулянтом и высушенный капилляр заполняют кровью из пальца (или венозной) на 7/8 длины. Укупоривают капилляр с одного конца специальной пастой (можно пластилином). Помещают в ротор центрифуги так, чтобы укупоренные концы упирались в резиновую прокладку, и центрифугируют 5 мин при 8000 об/мин. По отсчетной шкале, приложенной к центрифуге, определяют гематокритную величину.
Микрометод определения гематокрита (модификация И. Тодорова). Принцип. Центрифугирование крови определенное время при постоянном числе оборотов центрифуги с последующим определением результата по градуированным капиллярам. Реактивы те же.
Оборудование. Центрифуга. Пипетки от аппарата Панченкова (с отрезанным верхним концом и длиной 10–11 см).
Ход определения. В обработанную антикоагулянтом и высохшую пипетку набирают кровь из пальца (или венозную) до верхней метки (100 делений). Пипетку укупоривают, обтягивая ее резиновым кольцом, и центрифугируют 30–40 минут при 3000 об/мин. Результат отмечают по градуировке капилляра, вычитая из 100 высоту столбика эритроцитов.
Нормальные величины. У здоровых людей гематокрит венозной и капиллярной крови равен:
для мужчин — 40–48% (или 0,4–0,48);
для женщин — 36–42% (или 0,36–0,42);
у детей 0,5 мес. — 41–65%,
1 мес. — 33–55%;
2 мес. — 26–42%,
4 мес. — 32–44%,
6 мес. — 31–41%;
9 мес. — 32–40%,
12 мес. — 33-41%.
Клиническое значение. Снижение гематокрита характерно для анемий (до 20–25%), по его величине можно судить о степени анемии. Существенное увеличение (до 65%) наблюдается при полицитемии, менее значительное (50–55%) — при симтоматических эритроцитозах, сопутствующих порокам сердца, легочной недостаточности, некоторых гемоглобинопатиях. Величина гематокрита характеризует степень гемоконцентрации и гемодилюции. Используют значения гематокрита для расчетных показателей, характеризующих эритроциты: средний объем, средняя концентрация гемоглобина, а также для ряда биохимических показателей.
Определение гематокрита на гематологических анализаторах входит в программу. Обычно используют либо кондуктометрический, либо микроцентрифужный методы. В некоторых анализаторах гематокрит определяется расчетным путем, исходя из количества эритроцитов в определенном объеме крови (например, 1 мкл) и среднего объема одного эритроцита. Ход определения осуществляется в соответствии с инструкцией, прилагаемой к прибору.
В клинической практике используют различные расчетные характеристики, отражающие физико-химические свойства эритроцитов. Наиболее широко применяют расчет цветового показателя.
Цветовой показатель. Индекс отражает относительное содержание гемоглобина в эритроцитах. Вычисляют цветовой показатель определением отношения двух частных, полученных от деления количества гемоглобина на количество эритроцитов в норме и в исследуемой крови по следующей формуле:
ЦП= (Х гем/N гем) х (Х эр/N эр), где Хгем — найденное количество гемоглобина; Nгем — нормальное количество гемоглобина; Хэр — найденное количество эритроцитов; Nэр — нормальное количество эритроцитов.
Если принять, что в норме в 100 мл крови содержится 16,7 г гемоглобина и 5 000 000 эритроцитов в 1 мкл крови, то рассчитывают по формуле: ЦП= (Х гем/16,7) х (Х эр/5 000 000) = (Х гем х 5 000 000)/(Х эр х 16,7), при сокращении: ЦП= (Х гем х 3)/( Первые 2 цифры Х эр). В практической работе удобно пользоваться для подсчета цветового показателя пересчетными таблицам, а также номограммами.
Нормальные величины. У здоровых людей цветовой показатель находится в пределах 0,86–1,05.
Клиническое значение. По величине цветового показателя принято делить анемии на гипохромные, нормохромные и гиперхромные. Гипохромные анемии широко распространены (с цветовым показателем ниже 0,86) и наблюдаются прежде всего при дефиците железа, вызванном различными причинами. Особенно выраженной гипохромией (0,6–0,5 и ниже) характеризуются железодефицитные анемии, обусловленные хроническими кровопотерями. Менее выраженная гипохромия эритроцитов (0,7–0,8) наблюдается при железодефицитной анемии беременных, при инфекциях, опухолях. Редко встречаются гипохромные анемии, не связанные с дефицитом железа и обусловленные нарушением синтеза гемоглобина в результате свинцового отравления или наследственного повреждения синтеза порфиринов и цепей глобина (бета-талассемии, альфа-талассемии и др.). Повышение цветового показателя — гиперхромия — является характерным лабораторным признаком различных В12-дефицитных и фолиеводефицитных анемий. Особенно выражена гиперхромия эритроцитов (1,2 — 1,3) при рецидиве анемии Аддисона–Бирмера. Нормохромные анемии наблюдаются при некоторых гемолитических формах малокровия, острых кровопотерях, лейкозах, сопутствуют циррозу печени.
Среднее содержание гемоглобина в эритроците. Показатель отражает абсолютное содержание гемоглобина в одном эритроците в пикограммах (ПГ). Определяют путем деления концентрации гемоглобина на число эритроцитов.
МСН=((гемоглобин в г/л 1012 – полученный объем)/ Кол-во эритроцитов в 1 л) (ПГ), где МСН — Mean Corpuscular Hаemoglobin) поскольку 1г = 1012 ПГ, то формула после сокращения на 1012 (степень) принимается вид: МСН=((гемоглобин в г/л 1012)/ первые три цифры содержания эритроцитов в 1 л). Кроме того, расчет данного показателя можно произвести по номограмме (по Мазону) или с помощью современных автоматических гематологических анализаторов. Нормальные величины составляют 27–31 ПГ.
Клиническое значение. Показатель среднего содержания гемоглобина в эритроците важен для суждения о гипо- и гиперхромии эритроцитов. Снижение среднего содержания гемоглобина в эритроците (гипохромия) наблюдается вследствие уменьшения объема эритроцитов (микроциты) или понижения содержания гемоглобина в нормальном по объему эритроците. Таким образом, гипохромия не всегда сочетается с микроцитозом, а может быть и при нормо- и макроцитозе. Это истинный показатель дефицита железа в организме или железорефрактерности, т. е. неусвоения железа эритробластами и нарушения синтеза гема (сидеробластные анемии). Нормохромия обычно имеет место у здоровых людей, но может отмечаться и при некоторых анемиях (острых постгеморрагических, гемолитических, апластических). Гиперхромия зависит исключительно от толщины эритроцитов (макроциты, мегалоциты), а не от степени насыщения их гемоглобином. Это объясняется тем, что концентрация гемоглобина в эритроците имеет предельную величину, не превышающую 0,33 ПГ в 1 МКМ3 объема эритроцита. Гиперхромия с макроцитозом характерна для расстройства обмена витамина В12 или его дефицита (мегалобластные анемии), при некоторых гемолитических и миелотоксических анемиях, нарушениях функции печени.
Средняя концентрация гемоглобина в эритроците (МСНС — Mean Corpuscular Hаemoglobin Concentration). Показатель отражает степень насыщения эритроцита гемоглобином в процентах. Вычисляют среднюю концентрацию гемоглобина в эритроцитах по формуле: МСН = (гемоглобин в г/л/гематокрит в %) х 100. Данный показатель легко рассчитать, используя номограмму. Он входит в программу современных гематологических анализаторов.
Нормальные величины МСНС колеблются в пределах 33–38 %. Это довольно постоянная величина, и насыщение более 38 % встречается очень редко.
Клиническое значение. Снижение показателя отражает абсолютную гипохромию и является характерным для железодефицитных анемий. Чувствительность данного индекса эритроцитов при железодефицитных анемиях составляет 85 %. Снижение показателя выявлено также при мегалобластных анемиях, когда увеличение объема эритроцитов значительнее насыщения эритроцитов гемоглобином. Средний объем эритроцитов (MCV — Mean Corpuscular Volume). Показатель является важным при диагностике различных форм анемий. Вычисляют путем деления гематокритной величины на общее количество эритроцитов в крови: MCV = гематокрит в мкм3/число эритроцитов в 1 мкл.
Выражают в мкм3 или в фемтолитрах:1 фл = 1 х 10-15 л = 1 мкм3. Например, гемотокрит — 40 % (или 0,4 мм3, или 400 000 000 мкм3), эритроциты — 4 500 000 в 1 мкл, тогда MCV = 400 000 000/4 500 000= 88 мкм3.
Практически средний объем эритроцитов можно определить, разделив величину гематокрита в процентах на первые три цифры количества гемоглобина. В анализаторах измеряется по амплитуде импульсов, возникающих при прохождении клетки через апертуру, одновременно с подсчетом эритроцитов. Можно расчет вести по номограмме.
Нормальные величины: взрослые — 75–95 фл; новорожденные — 100 фл; дети до 1 года — 76–87 фл; дети 10–12 лет — 76–93 фл.
Клиническое значение. На основнии значений MCV анемии делят на микроцитарные, нормоцитарные и макроцитарные. Микроцитарными анемиями являются железодефицитная анемия, талассемия. Макроцитоз наблюдается при мегалобластных анемиях, особенно при В12- и фолиеводефицитных анемиях. Апластическая анемия является нормо- или макроцитарной. Показатели среднего объема эритроцита не всегда прямо коррелируют с показателем среднего диаметра эритроцита: так, при наследственном миросфероцитозе, при уменьшенном диаметре клетки объем вследствие характерной сфероцитарной формы нормальный или увеличенный.
Средний диаметр эритроцитов вычисляют из результатов эритроцитометрии путем умножения каждого процента клеток с определенным диаметром на его значение в мкм, суммированием этих произведений и делением на 100. Например, при эритроцитометрии 100 эритроцитов выявлено 10 % клеток с диаметром 6 мкм, 70% — 7,5 мкм, 20 % — 9 мкм. Средний диаметр эритроцитов вычисляют следующим образом: СДЭ = ((10 х 6) + (70 х 7,5) + (20 х 9)) = 7,65 мкм3
Нормальные величины СДЭ — 7,55 +/- 0,01 мкм.
Клиническое значение. Показатель менее информативен, чем другие показатели эритроцитометрии. Снижается при выраженных железодефицитных анемиях; повышается при В12-дефицитных анемиях.
Резистентность эритроцитов
Для оценки физико-химических свойств эритроцитов исследуют их резистентность к различным воздействиям. Наиболее часто в клинике определяют осмотическую резистентость эритроцитов. Различают минимальную и максимальную резистентность. Минимальная резистентность эритроцитов определяется максимальной концентрацией гипотонического (менее 0,85 %) раствора хлорида натрия (в серии постепенно уменьшающихся концентраций), при которой начинается гемолиз наименее устойчивых эритроцитов, находящихся в растворе 3 ч. Максимальная резистентность эритроцитов определяется максимальной концентрацией гипотонического раствора хлорида натрия, вызывающего в течение 3 ч гемолиз всех эритроцитов.
Унифицированная методика определения осмотической резистентности эритроцитов в модификации Л.И. Идельсона. Принцип. Количественное определение степени гемолиза эритроцитов в забуференных гипотонических растворах хлорида натрия.
Реактивы. Основной раствор (по осмотической концентрации соответствует 10%-му раствору хлорида натрия), pH 7,4: натрия фосфат двузамещенный безводный (Na2HPO4) — 27,31 г или двухводный (Na2HPO4 х 2H2O) — 34,23 г; натрия фосфат однозамещенный двухводный (NaH2PO4 х 2H2O) — 4,86 г; натрия хлорид — 180 г; дистиллированная вода — до 2 л. Раствор можно хранить в закрытой посуде в холодильнике в течение нескольких месяцев. Основной раствор разводят в 10 раз дистиллированной водой и получают раствор, по своей осмотической концентрации соответствующий 1%-ному раствору хлорида натрия. Из этого раствора готовят рабочие растворы, соответствующие растворам натрия хлорида следующих концентраций: 0,85; 0,75; 0,70; 0,65; 0,60; 0,55; 0,50; 0,45; 0,40; 0,35; 0,30; 0,20; 0,10 %. Целесообразно приготовить по 100 мл этих рабочих растворов. Хранят в холодильнике, пригодны в течение 2 недель.
Специальное оборудование. Фотоэлектроколориметр. Термостат на 37°С.
Ход определения: В две стерильные пробирки с 2 каплями гепарина (500 ЕД) вносят по 1,5 мл крови, перемешивают и одну используют для исследования, а вторую оставляют на сутки в термостате. В ряд центрифужных пробирок (14 шт.) разливают по 5 мл каждого из рабочих растворов с концентрацией натрия хлорида от 1 до 0,10%. В каждую пробирку добавляют по 0,02 мл гепаринизированной крови и оставляют на 30 минут при комнатной температуре. Центрифугируют смесь при 2000 об/мин. в течение 5 минут. Из каждой пробирки сливают надосадочную жидкость и фотометрируют при длине волны 500–560 нм (зеленый светофильтр) в кювете с толщиной слоя 1 см против контрольной пробы. Контрольная проба — надосадочная жидкость в пробирке, содержащая рабочий раствор с концентрацией хлорида натрия 1%. Расчет. За полный (100%) гемолиз принимают гемолиз в пробирке с 0,1%-ным раствором хлорида натрия. Вычисляют процент гемолиза в каждой пробирке, сравнивая величину экстинкции надосадочной жидкости с экстинкцией, принятой за 100% по формуле:(ЕX х 100)/ Е1, где Е1 — экстинкция надосадочной жидкости в пробирке с 0,1%-ным раствором хлорида натрия; ЕX — экстинкция исследуемой пробы; 100 — полный гемолиз в пробирке с 0,1%-ным раствором хлорида натрия. На следующий день повторяют исследования с кровью, инкубированной в течение 24 ч при 37°С.
Нормальные величины. У здоровых людей в свежей крови гемолиз (минимальная резистентность эритроцитов) начинается при концентрации хлорида натрия 0,50–0,45%, а полный гемолиз (максимальная резистентность эритроцитов) наблюдается в 0,40–0,35%-ном растворе хлорида натрия.
Клиническое значение. Исследование проводят при подозрении на гемолитическую анемию. Понижение осмотической резистентности, т. е. появление гемолиза эритроцитов при более высокой, чем в норме, концентрации хлорида натрия (0,70–0,75%) наблюдается при наследственном микросфероцитозе и некоторых наследственных несфероцитарных гемолитических анемиях, а также иногда при аутоиммунной гемолитической анемии. В ряде случаев понижение осмотической резистентности характерно для талассемии, гемоглобинопатий, возможно при механической желтухе.
В эритроцитах протекают различные метаболические процессы: гликолиз, пентозофосфатный путь окисления глюкозы, восстановление глутатиона, разрушение перекиси водорода и другие реакции метаболизма. Нарушения этих процессов могут быть связаны с наследственными дефектами синтеза ферментов (энзимопатии). Наиболее распространенной ферментопатией эритроцитов является нарушение синтеза глюкозо-6-фосфат-дегидрогеназы (Г-6-ФДГ) — ключевого фермента пентозофосфатного пути окисления глюкозы. Существует обратное соотношение между активностью Г-6-ФДГ и резистентностью эритроцитов, поэтому дефицит Г-6-ФДГ в клетке может приводить к гемолизу эритроцитов (гемолитический криз) при приеме пациентами ряда препаратов, действующих как оксиданты, — противомаллярийных средств (примахин), ацетилсалициловой кислоты, сульфаниламидов, нитрофуранов, 5-НОК, ПАСК, фенацитина и др. Для диагностики дефицита Г-6-ФДГ применяются как качественные методики, так и количественны определения ее активности в эритроцитах.
Тест на образование телец Гейнца-Эрлиха по Дейчи. Принцип. Появление в большом количестве окрашенных телец в патологических эритроцитах при их инкубации с метиловым фиолетовым.
Реактив. 0,5%-ный раствор метилового фиолетового в изотоническом растворе натрия хлорида. Ход исследования. В пробирке смешивают равные количества крови и раствора метилового фиолетового и оставляют на 10 минут. На предметном стекле готовят мазки, накрывают их покровным стеклом и микроскопируют с иммерсионным объективом.
Нормальные величины. У здоровых людей в эритроцитах наблюдается образование единичных телец красного цвета. Небольшое количество телец Гейнца обнаруживают в клетках новорожденных или больных после спленэктомии.
Клиническое значение. В эритроцитах с дефицитом Г-6-ФДГ обнаруживается 4–6 телец. Проба неспецифична, поскольку тельца Гейнца появляются в эритроцитах при передозировке сульфаниламидных препаратов, отравлениях анилиновыми красителями, дефиците других ферментов (глутатион-редуктазы, 6–фосфоглюконатдегидрогеназы), у носителей нестабильных гемоглобинов.
Качественная методика Мотульского-Кемпбеля. Принцип. Г-6-ФДГ является НАДФ-зависимым ферментом в первой реакции окислительной фазы пентозофосфатного пути окисления глюкозы. При ее участии образуется НАДФН, который восстанавливает (обесцвечивает) бриллиантовый крезиловый синий.
Реактивы.
Раствор натриевой соли глюкозо-6-фосфата: (825 мг в 100 мл дистиллированной воды).
Раствор НАДФ: 50 мг в 100 мл дистиллированной воды.
Раствор бриллиантового крезилового синего: 32 мг в 100 мл дистиллированной воды.
Трис-HCl-буфер с pH 8,5: 8,96 г трис (оксиметил) аминометана, 97 мл дистиллированной воды, 3 мл концентрированной соляной кислоты.
Парафин.
Ход исследования. В пробирку вносят 0,1 мл реактива 1, 0,1 мл реактива 2, 0,25 мл реактива 3, 0,2 мл реактива 4, перемешивают. В другую пробирку, куда предварительно налит 1 мл дистиллированной воды, вносят 0,02 мл крови из пальца (при анемии берут 0,04–0,06 мл). Смешивают содержимое обеих пробирок, смесь заливают 1–2 мл жидкого парафина и ставят на водяную баню при 37°С.
Нормальные величины. У здоровых людей смесь обесцвечивается через 40–55 минут.
Клиническое значение. Замедление времени обесцвечивания смеси более 90 минут свидетельствует о дефиците в эритроцитах Г-6-ФДГ. При гемолитической энзимодефицитной анемии обесцвечивание наступает через 3–24 часов.
Качественная методика по Бернштейну. Принцип. В присутствии Г-6-ФДГ образуется НАДФН, который обесцвечивает дихлорфенилиндофенол.
Реактивы.Раствор 2,6-дихлорфенилиндофенола: 14,5 мг в 100 мл трис-HCl-буферного раствора с pH 8,0. Буферный раствор состоит из 1,48 М раствора трис (оксиметил) аминометана (43,27 г в 250 мл дистиллированной воды) и 1,48 М раствора соляной кислоты (2 ампулы фиксанала, содержащего 0,1 моль-экв. HCl, доводят дистиллированной водой до 460 мл.
Раствор феназинметасульфата: 2 мл в 100 мл дистиллированной воды.
Раствор НАДФ: 2,3 мл в 1 мг дистиллированной воды.
Раствор глюкозо-6-фосфата: 15,2 мг натриевой соли Г-6-Ф в 1 мл дистиллированной воды. Из этих растворов готовят смесь реактивов: реактив 1 — 16 частей, реактив 2 — 2 части, реактив 3 — 1 часть и реактив 4 — 1 часть.
Ход исследования. В пробирку с 1 мл дистиллированной воды вносят 0,02 мл крови из пальца. После наступления гемолиза добавляют 0,5 мл смеси реактивов, оставляют при комнатной температуре на 15–20 минут, после чего оценивают изменение окраски.
Нормальные величины. У здоровых людей обесцвечивание смеси происходит через 15–20 минут.
Клиническое значение. Удлинение времени обесцвечивания свидетельствует о дефиците в эритроцитах Г-6-ФДГ. Неполное обесцвечивание за 30 минут соответствует незначительному уменьшению активности фермента, а отсутствие обесцвечивания к этому времени — резкому ее снижению.
Цитохимические исследования эритроцитов
Цитохимические методы исследования основаны на химических реакциях, позволяющих обнаружить в клетках полисахариды, липиды, нуклеиновые кислоты, ферменты и другие соединения. Цитохимические исследования обычно отличаются простотой, не требуют специального оборудования и дают ориентировочное представление о количестве определяемого вещества. При цитохимическом исследовании чаще всего пользуются полуколичественной оценкой результатов, основанной на степени интенсивности специфической окраски. В зависимости от нее делят все элементы на 4 степени:
отрицательные, т. е. неокрашенные (–),
слабо положительные (+),
положительные (++),
резко положительные (+++).
Цитохимические исследования эритроцитов проводят с целью выявления различных внутриклеточных включений, наличия разных форм гемоглобина, ферментных нарушений. Сидероциты и сидеробласты — это эритроциты и эритробласты (нормобласты), содержащие в цитоплазме негемоглобиновое железо в виде гемосидерина и ферритина.
Принцип. Использование реакции на берлинскую лазурь с образованием внутриклеточных гранул синего цвета.
Реактивы.2%-ный раствор железосинеродистого калия [K4Fe(CN6)].
0,1н раствор соляной кислоты: 8,2 мл концентрированной соляной кислоты довести дистиллированной водой до 1 л.
0,1%-ный раствор сафранина.
Метиловый спирт.
Ход исследования. Мазки крови или костного мозга фиксируют метанолом в течение 10–20 минут и высушивают на воздухе. Помещают их в смесь равных частей растворов 1 и 2 при температуре 50–56°С на 15–20 минут (на водяной бане). Промывают проточной водой в течение 10–15 минут и ополаскивают дистиллированной водой. Докрашивают раствором сафранина 3–5 секунд.
Нормальные величины. В периферической крови число сидероцитов не превышает 1,1% и составляет в среднем 0,6±0,04%; в костном мозге их несколько больше — 0,2±2,1%; количество сидеробластов (ядерных эритроцитов с железосодержащими гранулами) в костном мозге — 23,7±2,4%.
Клиническое значение. Снижение сидероцитов и сидеробластов характерно для железодефицитных анемий. Повышение железосодержащих клеток наблюдается при гемолитических анемиях, после спленэктомий, при миелодиспластическом синдроме (рефрактерной сидеробластной анемии), эритромиелозе.
Методика определения фетального гемоглобина по Бетке. Принцип.Элюция гемоглобина кислотой с докрашиванием мазков позволяет выявить эритроциты, содержащие гемоглобин F, по сохраненной окраске в отличие от обесцвеченных эритроцитов, содержащих гемоглобин А.
Реактивы. Цитратно-фосфатный буфер (pH 3,2):24,7 мл 0,2М раствора Na2HPO4 (35.6 г Na2HPO4 (35.6 г Na2HPO4х2H2О и до 1 л дистиллированной воды) и 75,3 мл 0,1М раствора лимонной кислоты (21,01 г лимонной кислоты и до 1 л дистиллированной воды).
1%-ный раствор метилового фиолетового или 1%-ный раствор эозина.
Этиловый спирт 80%.
Специальное оборудование. Микроскоп. Термостат на 37 °С.
Ход определения. Фиксируют мазки крови в 10%-ном этиловом спирте 5 минут. Промывают дистиллированной водой и высушивают. Погружают мазки на 5 минут в прогретый при 37 °С в течение 30 минут цитратно-фосфатный буфер (для элюции гемоглобина), периодически помешивая раствор стеклянной палочкой для удаления пузырьков воздуха. Ополаскивают мазки дистиллированной водой, высушивают фильтровальной бумагой. Докрашивают реактивом 2 в течение 2–3 минут. Промывают дистиллированной водой и высушивают.
Нормальные величины. У взрослых встречаются единичные окрашенные эритроциты (содержащие гемоглобин F); увеличение числа окрашенных эритроцитов наблюдается у новорожденных и детей до 5-месячного возраста.
Клиническое значение. Увеличение числа эритроцитов с HbF наблюдается у больных гомозиготной -талассемией (до5%), серповидноклеточной анемией (1–30%). До 10% HbF можно обнаружить при пароксизмальной ночной гемоглобинурии, рефрактерной сидеробластной анемии, острых лейкозах, врожденном хроническом миелолейкозе. Снижение HbF наблюдается при гемолитической анемии новорожденных.
Активность Г-6-ФДГ (К.Ф.1.1.1.49). Принцип. При окислении глюкозо-6-фосфата в пентозном пути окисления глюкозы с участием глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) образуется НАДФН, под влиянием которого тетразолий выявляется в виде гранул формазана.
Реактивы. 10%-ный раствор формалина. Инкубационная среда: глюкозо-6-фосфат — 3 мг в 1 мл дистиллированной воды; НАДФ — 1 мг в 1 мл дистиллированной воды; магния хлорид — 0,1 г в 1 мл дистиллированной воды; нитросиний тетразолий — 1 мг в 1 мл дистиллированной воды; (0,25М трис-HCl-буфер с pН 7,6 — 2,3 мл; феназинметасульфат — 0,5 мл.
Ход определения. На нефиксированные мазки крови наносят 0,1–0,2 мл инкубационной среды и помещают мазки в термостат при 37 °С на 75 минут. Фиксируют в 10%-ном растворе формалина в течение 10 минут при комнатной температуре. Высушивают на воздухе и микроскопируют.
Нормальные величины. В эритроцитах здоровых людей обнаруживают 10–20 гранул формазана. Клиническое значение. Снижение числа гранул формазана в эритроцитах или их отсутствие указывает на дефицит Г-6-ФДГ. Прием противомалярийных препаратов, фенацетина, больших доз аскорбиновой кислоты, некоторых сульфаниламидов у таких больных может вызвать гемолитическую анемию. Случаи гемолиза возможны при отравлении бобами, диабетическом ацидозе.
Скорость оседания эритроцитов (СОЭ, Erytrocyte Sedimentation Rate) — это скорость разделения несвернувшейся крови на два слоя: нижний, состоящий из осевших эритроцитов, и верхний — из прозрачной плазмы. Исследование СОЭ является одним из самых распространенных методов в лабораторной практике и входит в состав общего клинического анализа крови.
Унифицированная микрометодика Панченкова. Принцип. Свойство крови, смешанной с цитратом натрия, не свертываться при стоянии, а разделяется на два слоя: нижний — эритроциты, верхний — плазма. Расслоение происходит с различной скоростью в зависимости от изменения химических и физических свойств крови. Скорость оседания измеряется в мм за 1 час.
Реактив. 5%-ный раствор трехзамещенного цитрата натрия (C6N5O7Na3х5H2O). Раствор фильтруют. pH раствора должен быть нейтральным или слабощелочным. Помутневший раствор для употребления непригоден.
Специальное оборудование. Аппарат Панченкова, состоящий из штатива с гнездами и капилляров с просветом канала в 1 мм. На капиллярах нанесена миллиметровая шкала длиной 100 мм. Верхнее деление шкалы отмечено цифрой 0 и буквой К (кровь). Через каждые 10 делений имеются цифры 10, 20, 30 и т. д. до 100. Против деления 50 имеется буква Р (реактив). Отверстия концов капиллярных пипеток, вставленных в прибор, герметически закрываются резиновыми пробками. Капиллярные пипетки и пробирки должны быть химически чистыми.
Ход определения. Капиллярные пипетки предварительно промывают 5%-ным раствором цитрата натрия, набрав его до метки Р, и выливают в пробирку. Затем тем же капилляром из пальца набирают два раза кровь до метки К, каждый раз выливая ее в ту же пробирку (с антикоагулянтом). Полученное соотношение раствора и цитрата натрия — 1:4. Хорошо перемешивают, затем смесь набирают в капилляр до метки 0. Закрыв пальцем верхний конец капилляра, осторожно, чтобы кровь из капилляра не вылилась, устанавливают капилляр в штативе строго вертикально, упирая нижний его конец в резиновую прокладку и прижимая верхний конец прокладкой или пробкой. Через 1 час отмечают скорость оседания эритроцитов по высоте отстоявшегося слоя плазмы в миллиметрах.
Нормальные величины. У здоровых мужчин 1–10 мм/час, у женщин 2–15 мм/час. У детей на протяжении 1 года жизни СОЭ колеблется между 5,0 + 2,0 мм/час и 8,0 + 3,0 мм/час, в дальнейшем — между 7,0 + 3,0 мм/час и 9,0 + 3,0 мм/час.
Примечание. При температуре воздуха в помещении, где проводится исследование, ниже 20°С СОЭ замедляется, выше 20°С — увеличивается.
Ошибки при постановке СОЭ:
Нарушение соотношения крови и цитрата.
Неполное заполнение капилляра.
Неправильная постановка капилляра.
Некачественный раствор цитрата натрия.
Постановка СОЭ позже 2 часов после взятия крови.
Отклонение температуры.
Образование сгустка.
Грязный капилляр.
Неоткалиброванные капилляры.
Клиническое значение. Одной из основных причин увеличения СОЭ является изменение соотношения между белковыми фракциями крови в сторону увеличения доли крупнодисперсных белков. Играет роль и соотношение между холестерином и лецитином. Уменьшение количества эритроцитов также ведет к увеличению СОЭ. Наиболее частой причиной увеличения СОЭ являются воспалительные заболевания самой различной этиологии (пневмония, сепсис, холецистит), острые и хронические инфекции (туберкулез, инфекционный мононуклеоз, краснуха), инфаркт миокарда, анемии, оперативные вмешательства, беременность, гипопротеинемии. Особенно значительные величины СОЭ отмечены при парапротеинемических гемобластозах (до 60–80 мм/ч) и и симпоматических парапротеинемиях, сопутствующих злокачественным новообразованиям (особенно при распаде опухоли), хроническому активному гепатиту, циррозу печени, системным заболеваниям соединительной ткани. Замедление СОЭ наблюдается при истинной полицитемии, гиперпротеинемии, механической желтухе, вирусном гепатите и симптоматических эритроцитозах.
Ретикулоциты
Ретикулоциты — молодые эритроциты, образующиеся после потери нормобластами ядер. При нормальном эритропоэзе ретикулоциты в основном созревают в костном мозге в течение 2–3 дней, 24 часа они находятся в кровеносном русле и превращаются там в зрелые эритроциты. Если ретикулоциты попадают в кровь несозревшими, то время циркуляции увеличивается до 3 суток. Ретикулоциты являются отражением эритропоэтической активности костного мозга, высвобождения из костного мозга большого числа юных клеток.
Характерной особенностью ретикулоцитов является наличие в их цитоплазме зернисто-нитчатой субстанции, представляющей собой агрегированные рибосомы и митохондрии. Эта субстанция выявляется при суправитальной окраске (без предварительной фиксации). Зернисто-нитчатая субстанция в различных видах ретикулоцитов отличается полиморфизмом, У самых молодых ретикулоцитов субстанция обильная и имеет форму густого клубка. В более зрелых клетках она выявляется в виде сеточки, отдельных нитей, зерен. В мазках, окрашенных по обычным гематологическим методикам, ретикулоциты серовато-розового цвета, полихлороматофильны (окрашиваются разными красителями). Определить количество ретикулоцитов можно при микроскопии специально окрашенных мазков.
Унифицированная методика подсчета количества ретикулоцитов после окраски их непосредственно на стекле или в пробирке. Принцип. Суправитальная окраска красителями, выявляющими зернисто-нитчатую субстанцию ретикулоцитов.
Реактивы. Можно использовать один из следующих красителей. Насыщенный раствор бриллиантового крезилового синего в абсолютном этиловом спирте. Для приготовления абсолютного спирта надо выдержать 96%-ный этанол в нескольких сменах прокаленного порошка медного купороса. На 100 мл абсолютного спирта берут 1,2 г краски.
Раствор азура I по П.Н. Корикову: азур I — 1 г; аммония оксалат — 0,4 г; натрия хлорид — 0,8 г; 96%-ный спирт этиловый — 10 мл; дистиллированная вода — 90 мл.
Раствор краски в закрытом флаконе помещают на 2–3 дня в термостат при 37°С и периодически энергично взбалтывают. Затем охлаждают до комнатной температуры и фильтруют через бумажный фильтр. Раствор хранят в посуде из темного стекла. При появлении осадка краску следует снова профильтровать.
Раствор азура II: азур II — 1 г, натрия цитрат — 5 г; натрия хлорид — 0,4; дистиллированная вода — 45 мл. Раствор оставляют в термостате при 37°С на 2 суток, периодически помешивая. Для ускорения растворения краску можно прогреть на слабом огне в течение 15–20 минут, не доводя до кипения. Охлаждают до комнатной температуры и фильтруют. Хранят в посуде из темного стекла.
Ход определения. Окраска на стекле. Хорошо вымытое и обезжиренное предметное стекло подогревают над пламенем горелки. Стеклянной палочкой наносят на стекло каплю одного из красителей и готовят мазок из краски шлифованным стеклом. Маркируют сторону стекла, на которую нанесен мазок краски, стеклографом. В таком виде стекла можно заготовить впрок и хранить в сухом темном месте. Наносят каплю крови на мазок краски, готовят из нее тонкий мазок и немедленно помещают во влажную камеру на 3–4 минуты (можно пользоваться чашкой Петри с уложенными по краям валиками смоченной ваты, марли или фильтровальной бумаги), затем высушивают мазки на воздухе. В приготовленных таким образом мазках эритроциты окрашены в желтовато-зеленоватый цвет, зернисто-нитчатая субстанция — в синий цвет.
Окраска в пробирке. Методика 1: перед употреблением готовят в пробирке рабочий раствор бриллиантового крезилового синего из расчета: на 1 каплю 1%-ного раствора оксалата калия 4 капли раствора краски (реактив 1). В краску добавляют 0,04 мл крови (две пипетки до метки 0,02). Смесь тщательно, но осторожно перемешивают и оставляют на 30 минут. Перемешивают и готовят тонкие мазки.
Методика 2: в пробирку помещают 0,05 мл раствора краски 3 и 0,2 мл крови, Смесь тщательно перемешивают и оставляют на 20–30 минут. Перемешивают и готовят тонкие мазки.
Методика 3: в пробирку вносят 0,3–0,5 мм раствора краски 2 и 5–6 капель крови пипеткой от аппарата Панченкова. Пробирку закрывают резиновой пробкой, смесь тщательно, но осторожно перемешивают и оставляют на 1–1,5 часа (лучше окрашиваются ретикулоциты при экспозиции 1,5–3 часа). Перемешивают и готовят тонкие мазки.
Подсчет ретикулоцитов. В мазках эритроциты окрашены в желтовато-зеленоватый цвет, зернисто-нитчатая субстанция — в синий или синевато-фиолетовый цвет. Приготовленные одним из указанных выше способов мазки микроскопируют с иммерсионным объективом. Необходимо подсчитать не менее 1000 эритроцитов (большая точность получается при подсчете 2000–3000 эритроцитов) и отметить среди них количество клеток, содержащих зернисто-нитчатую субстанцию.
Практически для большей точности пользуются специальным окуляром, в котором можно уменьшить поле зрения до требуемых размеров. При равномерно тонких мазках, в которых эритроциты расположены в один ряд, подбирают такое поле зрения, в котором имеется, например, 50 эритроцитов, и затем просчитывают 20 таких полей зрения. При отсутствии готового окуляра его можно легко приготовить, для чего отвинчивают окуляр 7х, вкладывают в него кусок бумаги с вырезанным небольшим квадратиком и завинчивают. Количество подсчитанных ретикулоцитов выражают на 1000 мм на 100 эритроцитов.
Подсчет количества ретикулоцитов при помощи люминесцентной микроскопии. Принцип основан на флюоресценции зернисто-нитчатой субстанции ретикулоцитов после обработки крови акридиновым оранжевым.
Реактивы. Раствор акридинового оранжевого на изотоническом растворе хлорида натрия, концентрация 1:5000. Для приготовления изотонического раствора рекомендуется использовать дистиллированную воду с pH 5,8–6,8. Раствор акридинового оранжевого должен быть свежим. Его хранят не более 3–5 дней в посуде из темного стекла с притертой пробкой.
Нефлюоресцирующее иммерсионное масло. Можно использовать афлуоль или обычное иммерсионное масло с флюоресценцией, погашенной нитробензолом (0,3 мл нитробензола на 1 мл масла).
Специальное оборудование. Люминесцентный микроскоп.
Ход определения. Кровь смешивают с акридиновым оранжевым в пробирке или смесителе в соотношении: 1 часть крови и 10 частей краски (смесь можно хранить не более 5 часов), смесь перемешивают в течение 2 минут, каплю смеси наносят на предметное стекло и накрывают покровным стеклом. Микроскопируют со светофильтром ЖС-17. В препарате эритроциты не флюоресцируют, а в ретикулоцитах зернисто-нитчатая субстанция светится ярко-красным цветом. Замечено, что в крови, стабилизированной гепарином или цитратом натрия, флюоресценция ретикулоцитов не наблюдается. Методика отличается простотой и не требует много времени; благодаря яркому свечению ретикулоциты легко сосчитать.
Для подсчета ретикулоцитов служат гематологические анализаторы, снабженные дополнительным блоком, в котором их анализ производится по окраске митохондриальной РНК флюоресцентным красителем тиазоловым оранжевым. Возбуждение флюоресценции осуществляется аргоновым лазером. Более информативным является определение числа ретикулоцитов на разных стадиях развития по характеру ретикулярной сеточки в окрашенных препаратах. Поэтому, кроме общего количества ретикулоцитов, подсчитывают и процентное содержание различных групп ретикулоцитов. В зависимости от степени зрелости различают 5 групп ретикулоцитов (Кост Е.А. 1975):
1-я — ретикулоциты содержат ядро (нормоциты), зернистость располагается в виде плотного венчика вокруг ядра;
2-я — ретикулоциты имеют зернисто-сетчатую субстанцию в виде клубка или глыбки;
3-я — ретикулоциты имеют зернистость в виде густой сетки;
4-я — ретикулоциты имеют зернисто-сетчатую субстанцию в виде отдельных нитей;
5-я — ретикулоциты содержат отдельные зернышки.
Около 80% ретикулоцитов у здоровых людей относятся к 4-й и 5-й группам. При усиленной регенерации и остром эритромиелозе увеличивается содержание молодых форм ретикулоцитов (1–3 группы).
Степень усиления эритропоэза можно оценить количественным путем определения ретикулоцитарного индекса с учетом объема клеточной массы (ОКМ) или гематокрита (Харрисон Т.Р., 1993 г.): Ретикулоцитарный индекс = ретикулоциты (%) х (ОКМ больного / ОКМ в норме). Эта формула не вполне подходит для оценки распределения ретикулоцитов между костным мозгом и периферической кровью. При массивной стимуляции костного мозга ретикулоциты поступают в кровоток, не достигнув стадии зрелости. В связи с тем, что эти измененные незрелые ретикулоциты циркулируют в периферической крови в течение довольно продолжительного периода, ретикулоцитарный индекс следует разделить примерно на 2. Эта величина варьирует от 1,5 до 3 в зависимости от тяжести анемии и степени эритропоэтивной стимуляции.
Клиническое значение. Число ретикулоцитов в крови отражает регенеративные процессы костного мозга, и оценка его широко используется при различных анемиях. Повышение количества ретикулоцитов служит критерием активации кроветворения и наблюдается после кровопотери, при гемолитических анемиях, особенно в период криза (количество ретикулоцитов может быть 20–30%), а также на фоне лечения анемии Аддисона-Бирмера витамином В12 (ретикулоцитарный криз — подъем числа ретикулоцитов на 4–8-й день лечения), в начале ремиссии при гипопластической анемии, при эффективной терапии анемий, при малярии, а также у новорожденных. При таких состояниях, как острый эритроцитомиелоз, метастазы рака в костный мозг, ретикулоцитоз не является показателем хорошей регенераторной способности костного мозга. Снижение количества ретикулоцитов — показатель снижения интенсивности кровотворения. Наблюдается при апластической анемии, рецидиве В12-фолиеводефицитной анемии, железодефицитной анемии, при приеме цитостатических препаратов, лучевой терапии, заболеваниях почек.
Лейкоциты являются ядросодержащими клетками крови. Они формируют в организме человека мощный кровяной и тканевой барьеры против микробной, вирусной и паразитарной инфекций, поддерживают тканевой гомеостазис и регенерацию тканей. Это высокоспециализированные клетки, обладающие различными функциями.
Нейтрофильные лейкоциты участвуют в уничтожении проникших в организм инфекционных агентов, тесно взаимодействуя с макрофагами, Т- и В-лимфоцитами. Нейтрофилы секретируют вещества, обладающие бактерицидными эффектами, способствуют регенерации тканей, удаляя из них поврежденные клетки, а также секретируя стимулирующие регенерацию вещества. В цитоплазме лейкоцитов содержатся многочисленные мелкие гранулы трех типов.
Гранулы, дающие положительную реакцию на пероксидазу, представлены лизосомами, содержащими многочисленные энзимы: лизоцим, повреждающей клетку бактерий; катионные белки, нарушающие дыхание и рост микроорганизмов; протеазы и кислые гидролазы, позволяющие нейтрофилам легко переваривать фагоцитированные объекты. Гранулы, не окрашивающиеся на миелопероксидазу, содержат лактоферрин, оказывающий бактериостатическое действие, транскобаламины I и III — переносчики витамина В12 в крови, лизоцим. В гранулах третьего типа содержатся кислые глюкозаминогликаны, участвующие в процессах размножения, роста и регенерации тканей.
Базофильные лейкоциты. Базофильные гранулоциты крови и тканей (к последним относят и тучные клетки) выполняют множество функций: поддерживают кровоток в мелких сосудах, способствуют росту новых капилляров и трофике тканей, обеспечивают миграцию других лейкоцитов в ткани. Они способны к фагоцитозу, миграции из кровяного русла в ткани и передвижению в них. Базофильные лейкоциты участвуют в формировании аллергических реакций немедленного типа. Цитоплазма зрелых базофилов содержит гранулы неравных размеров. Базофилы могут синтезировать и накапливать в гранулах биологически активные вещества, очищая от них ткани, а затем секретировать их. Постоянно в клетке присутствуют:
1 — кислые глюкозаминогликаны и гепарин — основной антикоагуляционный фактор;
2 — гистамин — антагонист гепарина, укорачивающий время кровотечения, активатор внутрисосудистого тромбообразования. Гистамин стимулирует фагоцитоз, оказывает противовоспалительное действие на ткань. Базофилы оказывают свои эффекты благодаря дегрануляции, то есть выбросу содержимого гранул во внеклеточную среду.
Эозинофильные лейкоциты. Функции эозинофилов направлены на защиту организма от паразитарной гельминтной инфекции. Эозинофилы уменьшают концентрацию биологически активных соединений, возникающих при развитии аллергических реакций. Эозинофилы являются антагонистами тучных клетов и базофилов благодаря секреции соединений, предупреждающих длительное действие биологически активных веществ, выделяемых этими клетками. Эозинофилы обладают фагоцитарной и бактерицидной активностью. В цитоплазме присутствуют 2 типа гранул: Большие гранулы содержат специфический основной белок, обладающий свойством нейтрализовывать биологически активные вещества: гепарин, медиаторы воспаления. Маленькие гранулы содержат кислую фосфатазу и арилсульфатазу В, нейтрализующие «медленно реагирующую субстанцию аллергии». Для человека характерно накопление эозинофилов в тканях, контактирующих с внешней средой — в легких, желудочно-кишечном тракте, коже, урогенитальном тракте.
Моноциты-макрофаги (система фагоцитирующих макрофагов) обеспечивают фагоцитарную защиту организма от микробной инфекции. Образующиеся в макрофагах продукты метаболизма токсичны для многих паразитов человека. Макрофаги участвуют в формировании иммунного ответа организма и воспаления, усиливают регенерацию тканей и противоопухолевую защиту, участвуют в регуляции гемопоэза. Макрофаги фагоцитируют старые и поврежденные клетки крови. Макрофаги человека секретируют более 100 биологически активных веществ, что делает возможным их участие в регуляции гемопоэза, механизмов воспаления и т. п. Моноциты-макрофаги стимулируют фактор, вызывающий некроз опухоли (кахексин), обладающий цитотоксическим и цитостатическим эффектами на опухолевые клетки. Секретируемые макрофагами интерлейкин I и кахексин воздействуют на терморегуляционные центры гипоталамуса, повышая температуру тела.
Лимфоциты являются главными клеточными элементами иммунной системы организма. Основные функции иммунной системы состоят в способности отличать свои антигены от чужих и образовывать к ним антитела. Эти функции распределены между двумя классами лимфоидных клеток — Т-лимфоцитами и В-лимфоцитами, которые развиваются независимо друг от друга после отделения от общей клетки-предшественника лимфопоэза. Т-лимфоциты и часть В-лимфоцитов находятся в постоянном движении по периферическиой крови и тканевым жидкостям организма.
Уровень функциональной дифференцировки лимфоцитов не всегда можно определить морфологически в световом микроскопе, морфологические отличия свойственны лишь иммунобласту — бласттрансформированному под влиянием антигена лимфоциту. Т-лимфоциты делятся по меньшей мере на 4 субкласса: киллеров, уничтожающих чужеродные или собственные клетки-мишени, на поверхности которых в комплексе с аллоантигенами (HLA) представлены чужеродные антигены (вирусы, гаптены); хелперов Т-В, помогающих дифференцировке В-лимфоцитов в антителопродуцирующие клетки; эффекторов гиперчувствительности замедленного типа (ГЗТ), выделяющих гуморальные медиаторы (лимфокины), которые изменяют поведение других клеток, вовлекая их в реакцию (фактор активации макрофагов, фактор ингибиции миграции макрофагов, хемотаксические факторы для нейрофилов, эозинофилов, базофилов, митогенный фактор и др.), действуют на проницаемость сосудов (кожнореактивный фактор, гистаминстимулирующий фактор), обладают противовирусной активностью (лимфотоксин, интерферон) и т. д.; супрессоров, тормозящих иммунный ответ. В каждой линии Т-клеток — киллеров, хелперов, эффекторов ГЗТ, супрессоров — обнаружены клетки памяти, обладающие способностью при повторном контакте с антигеном выполнять соответствующую функцию быстрее и интенсивнее, чем при первичном контакте с тем же антигеном.
Система В-лифоцитов также подразделяется на множество мелких функциональных подсистем, способных реагировать с разными антигенами. Подобная специализация (клональная селекция) обеспечивает продукцию около миллиона различных антител. На часть антигенов (тимуснезависимых) В-лимфоциты отвечают самостоятельно, на большинство других (тимусзависимых) гуморальный иммунный ответ возможен при условии кооперирования В-клеток с Т-клетками (и макрофагами) и получения от Т-лимфоцитов (Т-хелперов) дополнительного сигнала. При первичной встрече с антигеном (первичный иммунный ответ) антителопродуцирующие потомки В-клеток синтезируют вначале (2–4 дня после иммунизации) антитела, относящиеся к JgM, затем (с 4 по 7 день), если доза антигена большая, происходит синтез антител класса JgG и в конечной стадии — JgA. Кроме того, при первичном ответе образуется клон В-лимфоцитов, обладающих иммунологической памятью. При вторичной иммунной стимуляции на большинство антигенов вырабатываются, главным образом, антитела класса JgG.
Радиоизотопными методами было подтверждено существование двух популяций лимфоцитов — коротко- и долгоживущих. Продолжительность жизни первых около 4 дней, вторых — в среднем около 170 дней. Распределение Т- и В-лимфоцитов в периферической крови человека следующее: 25–30% составляют В- и 60% — Т-клетки. Лимфоциты, на которых не выявляются ни Т-, ни В-рецепторы, названы нулевыми, содержание которых в периферической крови около 10%.
Таким образом, из приведенных данных видно, что лейкоциты крови выполняют в организме многообразные взаимосвязанные функции, направленные прежде всего на защиту организма от чужеродных влияний. При этом лимфоциты обеспечивают эту защиту, составляя основу специфического иммунитета, гранулоциты — благодаря, главным образом, фагоцитарной активности (фагоцитоз микробов и уничтожение их с помощью ферментов), моноциты — своим участием в иммунных реакциях, фагоцитозу и бактерицидному действию.
Длительность жизни лейкоцитов разнообразна и зависит от вида клеток. Полный цикл жизни гранулоцитов составляет 9–13 дней (5–6 дней они находятся в костном мозге, внутрисосудистый период — от нескольких часов до 2-х дней, остальная их жизнь проходит в тканях, где и осуществляются в основном их функции). Некоторые формы лимфоцитов (сохраняющие иммунологическую память) живут 300 дней. Есть и короткоживущая фракция лимфоцитов.
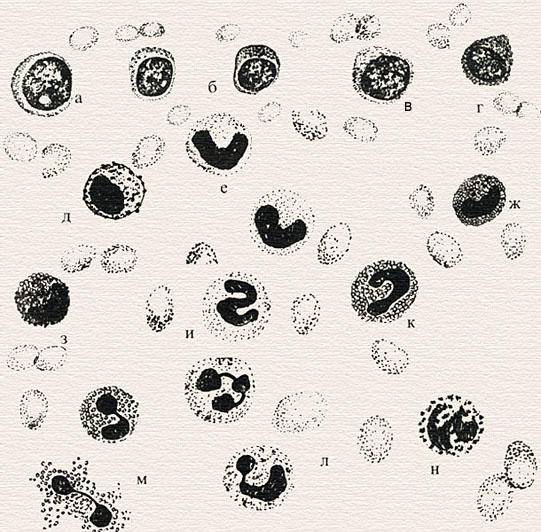
Морфология клеток гранулоцитарного ряда: а) миелобласт; б) промиелоцит; в) нейтрофильный миелоцит; г) эозинофильный миелоцит; д) базофильный миелоцит; е) нейтрофильные метамиелоциты; ж) эозинофильный метамиелоцит; з) базофильный метамиелоцит; и) нейтрофильный палочкоядерный миелоцит; к) эозинофильный палочкоядерный миелоцит; л) нейтрофильный сегментоядерный миелоцит; м) эозинофильный сегментоядерный миелоцит; н) базофильный сегментоядерный миелоцит.
Количество лейкоцитов зависит от внешних факторов: времени суток (максимум — в вечернее время), сезона, изменения климата и метеорологических условий, приема лекарственных препаратов, влияния диагностических процедур, физиологического состояния организма (возраста, пола, беременности, фазы менструального цикла, приема пищи, воздействия тепла или холода, физических нагрузок); и от патологических изменений в организме.
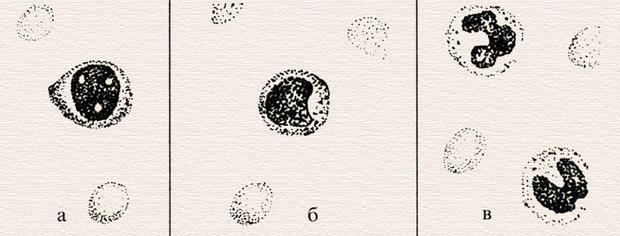
Морфология клеток моноцитарного ряда: а) монобласт; б) пронормоцит; в) моноциты.

Морфология клеток моноцитарного ряда: г) лимфобласт; д) пролимфоцит; е) лимфрцит; ж) плазмоцит; з) мегакариоцит зрелый без отшнуровки; и) мегакариоцит с отшнуровкой тромбоцитов.
Унифицированная методика подсчета лейкоцитов в счетной камере. Принцип. Подсчет лейкоцитов под микроскопом в определенном числе квадратов счетной камеры и расчет их количества в 1 л крови с учетом разведения крови и объема счетной камеры.
Реактив. 3–5%-ный раствор уксусной кислоты, подкрашенный для окраски ядер лейкоцитов несколькими каплями раствора метиленового синего. Раствор имеет голубой цвет, может длительно храниться.
Ход определения. В сухую пробирку наливают 0,4 мл реактива 1. Из пальца набирают 0,02 мл крови (можно использовать стабилизированную антикоагулянтом венозную кровь). Вытирают кончик пипетки, затем выдувают из нее кровь на дно пробирки, перемешивают, повторно набирая и выдувая смесь крови и реактива (пипетируя), маркируют пробирку и оставляют ее до момента счета. Хранить смесь крови с раствором уксусной кислоты рекомендуется не более 2–4 часов.
Кровь, разведенную в пробирке уксусной кислотой, тщательно перемешивают и заполняют ею счетную камеру. Заполненную камеру оставляют в горизонтальном положении на 1 мин. для оседания лейкоцитов. Не меняя горизонтального положения камеры, помещают ее на столик микроскопа и при малом увеличении (окуляр 10х, объектив 8х) подсчитывают лейкоциты в 100 больших квадратах. Лейкоциты считают по всей сетке в больших квадратах, не разделенных на малые квадраты и полосы, начиная с верхнего левого угла сетки. Для лучшего контрастирования затемняют поле зрения, опуская конденсор и закрывая диафрагму. Считают клетки, расположенные внутри квадрата и лежащие на любых двух линиях, чтобы дважды не подсчитывать одну и ту же клетку.
Расчет числа лейкоцитов проводят, исходя из разведения крови (20), числа сосчитанных квадратов (100) и объема одного большого квадрата 1/250, так как сторона квадрата 1/5 мм, высота 1/10 мм). Х = (а х 250 х 20)/100, где Х — число лейкоцитов в 1 мкл крови; а — число лейкоцитов в 100 больших квадратах; 20 — разведение крови; 100 — число больших квадратов;
250 — коэффициент пересчета на 1 мкл, т. к. объем одного большого квадрата равен 1/250 мкл.
Практически для расчета количества лейкоцитов в 1 мкл крови их число в 100 больших квадратах умножают на 50, а в 1 л — полученную величину умножают на 106. Х = а х 50, где Х — число лейкоцитов в 1 мкл крови; а — число лейкоцитов в 100 больших квадратах.
Примечание. При подсчете лейкоцитов неизбежна ошибка в 6–8% случаев.
Причины ошибок. При большом количестве нормоцитов в периферической крови их засчитывают в число лейкоцитов (и лейкоциты, и нормоциты — ядросодержащие клетки). Для того чтобы правильно установить количество лейкоцитов, надо из общего числа ядросодержащих клеток крови вычесть количество нормоцитов. Остальные причины ошибок аналогичны тем, которые возникают при подсчете в счетной камере количества эритроцитов.
Унифицированная методика подсчета лейкоцитов в гематологическом анализаторе. Принцип.
Большинство счетчиков основано на кондуктометрическом методе. Клетки, находящиеся в растворе электролита, проходя через электрическое поле, изменяют сопротивление электрической цепи. Возникший импульс регистрируется счетным устройством с цифровой индикацией. Кровь предварительно разводят и смешивают с каким-либо лизирующим эритроциты реактивом, например, раствором уксусной кислоты или сапонином.
Специальное оборудование. Гематологический анализатор.
Реактивы и ход определения по инструкции, прилагаемой к прибору фирмой-производителем.
Нормативные величины. Количество лейкоцитов в зависимости от возраста: при рождении 9,0–30,0 Г/л, 1 мес. 5,0–19,6 Г/л, 1–3 года 6,0–17,5 Г/л, 4–7 лет 5,5–15,5 Г/л, взрослые 4,0–9,0 Г/л.
Клиническое значение. В основе повышения количества лейкоцитов (лейкоцитоза) могут лежать различные патофизиологические механизмы, связанные с увеличением продукции, повышенной мобилизацией костномозгового резерва, а также перераспределением пристеночного пула. Перераспределенный лейкоцитоз обусловлен тем, что в сосудистом русле существует два пула лейкоцитов: пристеночный, или маргинальный, и циркулирующий. В связи с этим лейкоцитоз может развиваться вследствие поступления лейкоцитов из пристеночного пула или из органов, служащих для них депо. Это часто наблюдается при различных физиологических состояниях (физиологический лейкоцитоз):
физический лейкоцитоз (миогенные нагрузки);
пищеварительный лейкоцитоз (через 2–3 часа после приема пищи, особенно богатой белком);
беременность (особенно вторая половина);
эмоциональный стресс;
введение некоторых лекарственных препаратов (адреналин, кортикостероиды);
воздействие рентгеновских лучей и после физиотерапевтических процедур.
Наиболее частые причины патологического лейкоцитоза:
большинство острых инфекционных заболеваний (кроме брюшного тифа, бруцеллеза и вирусных инфекций);
воспалительные заболевания (крупозная пневмония, тонзиллит, экссудативный плеврит, перикардит);
инфаркты различных органов (миокарда, селезенки, легких);
гнойные процессы (сепсис, рожистое воспаление, менингит, аппендицит, перитонит, эмпиема плевры);
обширные ожоги (лейкоцитоз вызывается всасыванием продуктов тканевого распада и присоединением вторичной инфекции);
интоксикации;
уремия;
диабетическая кома;
шок;
острые кровопотери (постгеморрагический лейкоцитоз вследствие гипоксемии);
гемолитический криз;
почечная колика;
аллергические реакции;
в ряде случаев — злокачественные новообразования, особенно при распаде опухолей.
Умеренный лейкоцитоз может быть при истинной полицитемии, при злокачественных лимфомах с поражением костного мозга, иногда при острых лейкозах, в начальных стадиях хронических лейкозов. Значительное повышение числа лейкоцитов (более 200 Г/л) имеет место при хроническом миелолейкозе и хроническом лимфолейкозе. Снижение количества лейкоцитов — лейкопения. Причины лейкопений (Алмазов В. А., 1981 г.):
недостаточность кроветворения в костном мозге (лейкопении центрального генеза) в результате гибели стволовых клеток (некоторые формы острого лейкоза, лучевая болезнь, метастазирование новообразований в костный мозг), жирового перерождения костного мозга (апластическая анемия) или развития соединительной ткани (хронический миелофиброз). К развитию лейкопений центрального генеза приводит воздействие ионизирующей радиации, бензола, прием некоторых лекарственных препаратов (производные пиразолона, нестероидные противовоспалительные препараты, антибиотики, особенно левомицетин, сульфаниламидные препараты, цитостатические средства и др.);
при сохранении кроветворения может быть нарушен выход лейкоцитов из костного мозга в периферическую кровь (синдром ленивых лейкоцитов);
при сохраненном кроветворении количество лейкоцитов снижается в результате их усиленного разрушения в кровеносном русле или при увеличении пристеночного пула (перераспределительные лейкопении). К развитию периферических лейкопений приводят некоторые заболевания, протекающие со спленомегалией и синдромом гиперспленизма (хронический активный гепатит, цирроз печени, болезнь Гоше, синдром Фенти). Функциональные лейкопении наблюдаются при гипотонических состояниях, упадке общего тонуса, голодании. Лейкопении развиваются при вирусных и бактериальных инфекциях (брюшной тиф, грипп, малярия, бруцеллез, вирусный гепатит, корь, краснуха); аутоиммунных заболеваниях (системная красная волчанка).
Лейкоцитарная формула
Лейкоцитарную формулу — процентное соотношение различных видов лейкоцитов — подсчитывают в окрашенных мазках крови. Диагностическое значение имеют абсолютные количества отдельных видов лейкоцитов, которые можно высчитать по формуле: количество нейтрофилов = % нейтрофилов х количество лейкоцитов.
Унифицированная методика морфологического исследования форменных элементов крови с дифференцированным подсчетом лейкоцитарной формулы. Принцип. Микроскопия сухих фиксированных и окрашенных мазков крови с дифференцированием различных форм лейкоцитов. Подготовка предметных стекол, приготовление мазков крови, их фиксация и окраска изложены ранее при исследовании морфологии эритроцитов.
Реактивы. Иммерсионное масло. Диэтиловый эфир.
Специальное оборудование. Микроскоп. Счетчик для подсчета лейкоцитарной формулы.
Ход исследования. Предметное стекло с окрашенным, высохшим на воздухе мазком крови помещают на столик микроскопа и с помощью малого увеличения (окуляр 7х, объектив 8х) находят край мазка. Не меняя положения стекла, наносят каплю иммерсионного масла на край мазка, на место, расположенное под объективом. Переводят иммерсионный объектив (90х) в вертикальное по отношению к мазку положение, при этом объектив погружается в каплю масла. Осторожно вращают макровинт до появления в поле зрения микроскопа изображения. Затем с помощью микровинта устанавливают четкую видимость препарата. Критерием правильно подобранного для каждого глаза фокусного расстояния будет ясное изображение клеток с четкими границами и внутриклеточной структурой.
Приступают к дифференцированию лейкоцитов, отличая клетки с помощью счетчика. Необходимо просчитывать не менее 100 лейкоцитов. Если при исследовании выявляется какой-то патологический процесс, то изучению подлежат 200–400 и даже более лейкоцитов.
В связи с тем, что более крупные клетки (моноциты, нейтрофилы, миелобласты) располагаются больше по периферии, вдоль верхнего и нижнего краев мазка, а более мелкие (лимфоциты, микромиелобласты) находятся ближе к его центру, подсчет клеток призводят всегда по одной и той же схеме: половину клеток считают на одном конце мазка, а другую — на противоположном. Счет ведут по зигзагу (линия «меандра»): отступив 3-4 поля зрения по краю мазка, затем 3–5 полей зрения под прямым углом к середине мазка, затем 3–5 полей зрения параллельно краю мазка, возвращаются к краю мазка, где просчитывают 3–5 полей зрения. Такое движение при счете продолжают до тех пор, пока не сосчитают половину клеток, а затем переходят на противоположный край, где подсчитывают вторую половину клеток. При исследовании лейкоцитарной формулы необходимо дифференцировать неразрушенные лейкоциты.
Лейкоконцентрат
В связи с тем, что при целом ряде заболеваний у больных часто имеет место выраженная лейкопения, когда исследование лейкоцитарной формулы и обнаружение патологических элементов (например, бластов при острых лейкозах, миеломных клеток при миеломе) затруднено, целесообразно приготовление лейкоконцентрата. Все существующие методики лейкоконцентрации основаны на: гемолизе эритроцитов, центрифугировании, седиментации. Наиболее физиологичны и распространены методы, основанные на седиментации форменных элементов крови.
Методика лейкоконцентрации с гепарином рекомендуется при необходимости удаления тромбоцитов. Принцип. При центрифугировании плазмы, разведенной холодным изотоническим раствором хлорида натрия, тромбоциты оседают, а лейкоциты остаются во взвешенном состоянии в плазме.
Реактивы. Гепарин 500 ед/мл.
0,85%-ный раствор хлорида натрия.
Краска Романовского-Гимзы или азур-эозин.
Метанол для фиксации мазков.
Специальное оборудование. Микроскоп. Центрифуга.
Ход исследования. В пробирку с 1 мл гепарина вносят 4 мл венозной крови, перемешивают переворачиванием пробирки. Отстаивают в течение 40–45 минут. Пастеровской пипеткой (можно автоматической) осторожно, стараясь не захватить эритроциты, отбирают плазму и переносят в центральную пробирку. Центрифугируют при 1500 об/мин в течение 10 минут. Удаляют надосадочную жидкость, а к осадку добавляют 5 мл холодного физиологического раствора (0,85%-ный раствор хлорида натрия). Центрифугируют при 500–800 об/мин. 10–15 минут. Если в осадке имеется примесь эритроцитов, необходимо повторно промыть и отцентрифугировать осадок с холодным раствором хлорида натрия. Из осадка готовят мазки, фиксируют и окрашивают их по общепринятым гематологическим методикам.
Методика концентрации лейкоцитов с использованием трилона Б. Принцип. В результате ускорения оседания эритроцитов при добавлении в кровь раствора трилона Б получается плазма, содержащая лейкоциты.
Реактивы. 3%-ный раствор трилона Б (этилендиаминтетраацетат натрия, ЭДТА).
Краска Романовского-Гимзы или азур-эозин.
Метанол для фиксации мазков.
Специальное оборудование. Микроскоп. Термостат на 37°С. Центрифуга.
Ход исследования. В пробирку с 1 мл 3%-ного раствора трилона Б вносят 4 мл венозной крови, осторожно перемешивают, наклоняя пробирку, ставят в термостат при 37 0С или оставляют при комнатной температуре на 30–45 минут. За это время над эритроцитами отстаивается слой плазмы в 2–3 мл. Пастеровской пипеткой (можно автоматической), стараясь не захватить эритроциты, отсасывают плазму и вносят в центрифужную пробирку, центрифугируют при 1000 об/мин. в течение 10 минут. Удаляют надосадочную жидкость, на предметное стекло пастеровской пипеткой наносят каплю осадка, готовят из нее мазок, фиксируют и окрашивают по общепринятым гематологическим методикам.
Существенное преимущество исследования окрашенного мазка лейкоконцентрата перед исследованием мазков периферической крови имеется при острых лейкозах, особенно в алейкемической стадии, при лимфогрануломатозе, миеломной болезни и др. Оно позволяет выявить бластные клетки, оценить полноту ремиссии при остром лейкозе. Кроме того, лейкоконцентрат используют для проведения цитохимических исследований, имеющих важное диагностическое значение при острых лейкозах. При миелопролиферативных заболеваниях, особенно при доброкачественном сублейкемическом миелозе, в мазках лейкоконцентрата обнаруживаются ядра мегакариоцитов. При лимфогрануломатозе, миеломной болезни выявляется повышенное содержание плазматических клеток. При лимфогрануломатозе могут быть найдены предстадии клеток Березовского-Штернберга. Важным является исследование лейкоконцентрата при системной красной волчанке для выявления LE-клеток.
Волчаночные клетки служат морфологическим проявлением иммунологического феномена, характерного для системной красной волчанки. Они образуются в результате фагоцитоза нейтрофильными лейкоцитами (реже моноцитами) ядер клеток, содержащих деполимеризованную ДНК. Предполагают, что фагоцитируемая субстанция представляет собой иммунный комплекс, состоящий из волчаночного фактора (антинуклеарного фактора), остатков ядер лейкоцитов и комплемента.
В 1963 году были выделены три фазы клеток красной волчанки:
расщепление ядерного вещества лейкоцитов, появление в цитоплазме нейтрофильных лейкоцитов крупных гомогенных масс, окрашивающихся в розовато-фиолетовый цвет;
феномен «розетки» — расположение нейтрофилов вокруг более крупных образований, находящихся внеклеточно и еще не поглощенных лейкоцитами;
раздробленная ядерная масса, фагоцитированная нейтрофилами, включена в цитоплазму этих клеток, занимает центральную часть клетки и выталкивает ядро на периферию, где оно принимает форму полумесяца или серпа.
Иногда обнаруживаются нейтрофилы, в которых фагоцитированная субстанция не имеет гомогенного характера, а сохраняет структуру хроматина. Это клетки Тарта, их рассматривают как предстадию LE-клеток. Специфичными для красной волчанки считают только типичные LE-клетки.
Для исследования LE-феномена предложены многочисленные методы, в основе которых лежит инкубация клеток больного в собственной плазме с дополнительным травматическим (механическим, ультразвуковым) воздействием на кровь; в результате из поврежденных ядер клеток освобождаются нуклеопротеины, формируются гематоксилиновые тельца, которые фагоцитируются неповрежденными нейтрофиламии в присутствии антинуклеарного фактора.
Методика Харгревеса-Циммера. Принцип. Механическое повреждение лейкоцитов для усиления LE-феномена.
Реактивы. Метиловый спирт. Краска Романовского-Гимзы или азур-эозин.
Специальное оборудование. Микроскоп.
Металлическое сито.
Фарфоровый пестик.
Центрифуга.
Ход исследования: в пробирку набирают 10 мл венозной крови и оставляют при комнатной температуре (можно в термостате при 37°С) на 2 часа. Свернувшуюся кровь выливают на металлическое сито, поставленное на чашку Петри, и фарфоровым пестиком протирают сгусток. Содержимое чашки Петри переносят в цетрифужную пробирку и центрифугируют при 2000 об/мин. в течение 5 минут. Надосадочную жидкость удаляют, а из верхнего слоя осадка готовят мазки. Высохшие мазки фиксируют метанолом и окрашивают по принятым в гематологии методикам.
Методика Цинкхама-Конли в модификации Е.Н. Новоселовой. Принцип. Механическое воздействие на кровь, облегчающее образование LE-феномена.
Реактивы. Натрия оксалат. Краска Романовского-Гимзы или азур-эозин. Метиловый спирт для фиксации мазков.
Специальное оборудование. Микроскоп. Центрифуга. Стеклянные бусинки диаметром 3–4 мм.
Ход исследования. В пробирку с 10 мл оксалата натрия вносят 10 мл венозной крови, тщательно перемешивают и оставляют стоять на 1,0–1,5 часа при комнатной температуре. Вносят в пробирку 8–10 стеклянных бусинок диаметром 3–4 мм, плотно закрывают пробкой и перемешивают, переворачивая пробирку пробкой то вверх, то вниз в течение 30 минут. Затем отстаивают в течение 1 часа при комнатной температуре для разделения слоев. Плазму отсасывают пастеровской пипеткой и вносят в центрифужную пробирку. Центрифугируют при 1000 об/мин. в течение 5 минут. Надосадочную жидкость удаляют, а из осадка готовят мазки. Высохшие мазки фиксируют в метиловом спирте и окрашивают по принятым в гематологии методикам.
Нормальные величины. У здоровых людей LE-клетки в крови отсутствуют.
Клиническое значение. LE-клетки обнаруживаются у 70–80% больных СКВ с активными проявлениями болезни, достигая количества 10–20 клеток и более на 1000 нейтрофилов (Насонова В. А., Асташенко М. Г., 1989). Исследование целесообразно проводить до начала специфической терапии. Отрицательный результат не отвергает диагноз: это, возможно, в ранний период заболевания, при большой потере белка с мочой. Небольшое количество LE-клеток обнаруживается при хроническом активном гепатите, смешанном заболевании соединительной ткани, лекарственной СКВ, узелковом периартериите, дерматомиозите, а единичные — при системном ревматоидном артрите.
Морфологические особенности лейкоцитов
При дифференциации лейкоцитов в окрашенных препаратах имеют значение следующие морфологические признаки:
величина и форма клетки (молодые клетки преимущественно крупнее зрелых, форма клеток чаще круглая, реже неправильная);
ядерно-цитоплазматическое соотношение (отношение ядро/цитоплазма обычно тем выше, чем моложе клетка);
форма ядра и его хроматиновое строение (форма ядра у молодых клеток круглая или слегка вогнутая, рисунок ядра более нежный, цвет более светлый, ядра богаты оксихроматином; у зрелых клеток более грубый ядерный хроматин, ядра темно-фиолетового цвета, содержат базихроматин);
наличие или отсутствие нуклеол в ядре, их число и величина (нуклеолы, обычно светло-синего или светло-фиолетово-синего цвета, присутствуют в ядрах бластных клеток);
цвет и структура цитоплазмы (цитоплазма молодых клеток базофильна, при созревании становится оксифильной, в ряде клеток вокруг ядра есть просветление);
наличие в цитоплазме зернистости (величина, цвет), вакуолей, пигментных зерен и фагоцитированных элементов паразитов, эритроцитов).
Лейкоциты периферической крови делятся на гранулоциты и агранулоциты (лимфоциты, моноциты). Гранулоциты — клетки, в цитоплазме которых определяется зернистость, специфическая для определенного вида клеток: различают нейтрофильную, эозинофильную и базофильную зернистость. Нейтрофильная зернистость розовато-фиолетовой окраски, чаще пылевидная, овальная, не всегда равномерно заполняет цитоплазму. Эозинофильная зернистость однородна по цвету, форме, величине, крупная — занимает всю цитоплазму. В зрелых клетках эозинофильного ряда она имеет кирпично-розовый цвет (кетовая икра), в молодых — коричневый и буро-синий оттенок.
Базофильная зернистость чаще фиолетового, реже черного цвета, неоднородна по величине и форме, обычно нестабильна, располагается на ядре и в цитоплазме. Лимфоциты и моноциты могут содержать азурофильную зернистость розовато-фиолетового цвета, которая называется неспецифической. Палочкоядерные нейтрофильные гранулоциты — это клетки размером 10–15 мкм, имеющие темно-фиолетовое ядро, узкое, вытянутое в виде палочки средней толщины, часто изогнутой. Структура ядра грубая, неравномерная, крупноглыбчатая, без нуклеол. Цитоплазма розоватого цвета, иногда с фиолетовым оттенком, занимает большую часть клетки, содержит обильную, неравномерную мелкую розовато-синюю или бледно-фиолетовую зернистость.
Сегментоядерные нейтрофильные гранулоциты имеют размер 10–15 мкм, полиморфное узкое ядро разделено на 3–5 отдельных сегментов, соединенных тонкими, не всегда заметными перемычками. Базихроматин ядра скапливается в отдельные грубые комочки, преимущественно по периферии ядра, окрашивая его в темно-фиолетовый цвет. Структура ядра неравномерная, крупноглыбчатая цитоплазма розоватого цвета, содержит обильную, мелкую, бледно-фиолетовую зернистость. Ядерно-цитоплазматическое отношение сдвинуто в пользу цитоплазмы. Полисегментированные нейтрофилы (6–12 сегментов и более) встречаются при патологии — В12-дефицитной анемии, хроническом миелофиброзе, лучевой болезни.
Эозинофильные гранулоциты — клетки размером 12–15 мкм, имеют более крупное ядро, чем у нейтрофилов, и меньшее число сегментов (2 или 3). Ядро рыхлое, окрашивается бледнее, чем у нейтрофильных гранулоцитов, а цитоплазма бледно-розовая (бледно-голубая у палочкоядерных эозинофильных гранулоцитов). Зернистость обильная, крупная, розовая, занимает всю цитоплазму.
Базофильные гранулоциты имеют несколько меньший размер — 8–12 мкм. Ядро сегментоядерных базофилов сравнительно крупное, темноокрашенное, бесструктурное, расплывчатое и редко раздельно более чем на две части. Базофильные сегментоядерные гранулоциты имеют трехсегментированное, сравнительно крупное ядро фиолетового цвета, иногда неопределенной формы или в виде листа растения. Структура ядра неравномерная, крупноглыбчатая; цитоплазма фиолетовая или бледно-розовая, нередко с размытыми участками (часть зерен растворяется в воде), содержит нестабильную, неравномерную зернистость грязноватого темно-фиолетового цвета, расположенную на ядре и в цитоплазме. Сегментоядерные базофилы отличить от палочкоядерных форм в большинстве случаев невозможно из-за обильной зернистости, покрывающей ядро.
Лимфоциты представляют собой уникальную по разнообразию популяцию клеток, происходящих из различных предшественников и объединяемых единой морфологией. По происхождению лимфоциты подразделяются на две основные субпопуляции: Т-лимфоциты и В-лимфоциты. Выделяют также группу лимфоцитов, не имеющих на мембране типичных маркеров Т- и В-клеток и называемых «ни Т, ни В» или «О-лимфоциты» (null (lymphocytes). Деление клеток лимфатического ряда по степени зрелости на основании морфологических черт является условным и не может претендовать на последовательность пролиферации и дифференцировки, как в других ростках кроветворения. Очень часто клетки-предшественники при световой микроскопии принимают за лимфоциты.
Лимфоциты — один из самых полиморфных классов клеток, изучение лимфоцитов крови здоровых людей в световом и электронном микроскопе показало, что по размерам, морфологическому строению эти клетки неоднородны (Файнштейн Ф. Э. и соавт., 1978). Большие лимфоциты (12 % от общего числа лимфоцитов) характеризуются присутствием в цитоплазме свободных рибосом, митохондрий и длинных канальцев эндоплазматической сети. В этих клетках ядро крупное, широкая зона цитоплазмы, хроматин менее плотный, чем у малых лимфоцитов, распределяется равномерно, почти всегда обнаруживается ядрышко.
Малые светлые лимфоциты составляют 75 % всех лимфоцитов периферической крови и отличаются от других групп клеток бедной органеллами цитоплазмой. Из-за небольшого количества рибосом их цитоплазма выглядит светлой. Ядро занимает практически всю клетку, приближаясь к сферической форме. Иногда в ядрах обнаруживается довольно глубокая борозда или вырез, хроматин, как правило, имеет вид грубых, компактных глыбок. Значительный объем ядра по отношению к цитоплазме составляет существенный морфологический признак лимфоцита.
Малые темные лимфоциты (12 %) содержат большое число рибосом в цитоплазме, что обусловливает их темное окрашивание в световом микроскопе, гранулярная эндоплазматическая сеть развита слабо. Лимфоплазмоциты в периферической крови здоровых людей встречаются редко (1 %), ядерно-цитоплазматическое отклонение сдвинуто в сторону увеличения ядра. Ядро обычно крупное, но иногда с одной или несколькими выемками, расположено в центре клетки или эксцентрично. Плотный хроматин распределяется неравномерно, в основном сконденсирован вдоль ядерной мембраны. В ядре видно одно, реже два ядрышка, имеющих компактную или кольцевидную форму.
Е. А. Кост (1975) описывает в крови здоровых лиц два вида зрелых лимфоцитов. Узкоцитоплазменные лимфоциты встречаются наиболее часто. Это довольно маленькие клетки, размер которых колеблется от 7 до 9 мкм, ядро темно-фиолетовое, крупное, овальное или с небольшими неровностями контуров. Иногда ядро имеет вдавление, что придает ему бобовидную форму. Структура ядра компактная, часто состоит из плотных, грубых комков базихроматина, что создает впечатление глыбчатости, цитоплазма располагается в виде узкого ободка, часто едва заметного, светло-синего цвета, может быть просветление вокруг ядра. Единичные азурофильные включения в узкой цитоплазме практически невидимы.
Широкоцитоплазменные лимфоциты могут достигать 12–13 мкм в диаметре. Это клетки в более бледным ядром, нередко бобовидной формы и широким ободком менее интенсивно окрашенной серовато-синей или голубоватой цитоплазмы. Околоядерное просветление менее отчетливое, чем у лимфоцитов с узким ободком цитоплазмы. Некоторая часть лимфоцитов имеет в цитоплазме неспецифическую азурофильную зернистость, окрашивающуюся в красный или фиолетовый цвет.
Моноциты — самые крупные клетки, размером 12–20 мкм. Ядро занимает большую или равную с цитоплазмой часть клетки, светло-фиолетовое, иногда голубоватое или красно-фиолетовое, полиморфной формы — округлое, бобовидное, трехлопастное с нежной, равномерной, крупносетчатой структурой (как бы разрежено). Нити базихроматина в виде извилистых, грубых тяжей образуют широкую сетку с утолщениями. В ячейках сетки имеются значительные просветления за счет оксихроматина. Цитоплазма бледно-голубая или сероватая, иногда синяя, часто содержит в большом количестве мелкую, пылевидную, азурофильную зернистость. Нередко в цитоплазме содержатся вакуоли, расположенные вокруг ядра, фагоцитированные клетки, пигментные зерна.
Клиническое значение изменений лейкоцитарной формулы
Исследование лейкоцитарной формулы имеет большое значение в диагностике большинства гематологических заболеваний, для оценки тяжести состояния и эффективности проводимой терапии. Изменения лейкоцитарной формулы имеют место при целом ряде заболеваний, порой они являются неспецифическими.
Изменение числа нейтрофилов
Увеличение числа нейтрофилов (нейтрофилез или нейтроцитоз), как правило, сочетается с увеличением общего числа лейкоцитов в крови. Нейтрофильный лейкоцитоз развивается вследствие увеличения продукции нейтрофилов, повышенной мобилизации костномозгового резерва или перераспределения пристеночного пула. Нейтрофилез наблюдается при инфекциях:
бактериальных (сепсис, гнойные инфекции);
вызванных простейшими (грибковые, паразитарные заболевания);
злокачественных новообразованиях;
острых и хронических лейкозах;
эритремии;
гемолитической анемии;
травмах тканей;
инфарктах миокарда, легкого;
некротических состояниях;
состояниях после кровотечения;
метаболических заболеваниях (уремия, диабетический кетоацидоз, подагра);
приеме лекарственных препаратов (кортикостероиды, адреналин).
При ряде заболеваний отмечаются изменения в соотношении между различными формами нейтрофилов. Увеличение количества незрелых нейтрофилов (миелоцитов, метамиелоцитов, палочкоядерных нейтрофилов) в периферической крови называется сдвигом лейкоцитарной формулы влево. Степень зрелости ядер нейтрофилов определяется индексом сдвига ядер. Индекс сдвига ядер (ИС) вычисляют по формуле: ИС = (миелоциты + метамиелоциты + палочкоядерные) / сегментоядерные. В норме ИС составляет 0,06.
При тяжелом течении воспалительного процесса рассчитывается лейкоцитарный индекс интоксикации (ЛИИ) по формуле: ЛИИ =((4Мл + ЗЮ + 2П + С) х (Пл + 1)) / ((М + Л) х (Э + 1)), где Мл — миелоциты, Ю — юные, П –палочкоядерные, С — сегментоядерные, Пл — плазматические клети, М — моноциты, Л — лимфоциты, Э — эозинофилы. В норме ЛИИ — 0,3–1,5.
При некоторых видах патологии, сопровождающихся выраженной интоксикацией, гранулы нейтрофилов могут приобрести грубые очертания, темную окраску из-за нарушения процесса дегрануляции. Этот характер зернистости называется токсической (токсогенной) зернистостью. Определяется она в окрашенных мазках крови. В норме ее содержат 0–2 % клеток.
Сдвиг лейкоцитарной формулы. Сдвиг лейкоцитарной формулы влево имеет место при:
инфекциях, отравлениях;
после кровотечений, хирургических вмешательств;
гематологических заболеваниях;
аномалии Пельгера-Хьюэта.
Сдвиг вправо имеет место при: мегалобластических анемиях; болезнях печени и почек; наследственной гиперсегментации.
Снижение числа нейтрофилов (нейтропения) обычно сочетается с лейкопенией и наблюдается при:
вирусных инфекциях (гепатит, корь, грипп);
инфекциях, вызванных простейшими (гистоплазмоз токсоплазмоз, малярия);
риккетсиозных инфекциях;
агранулоцитозе;
лечении цитостатиками и ионизирующим излучением;
приеме некоторых медикаментов (производных пиразолона, нестероидных противовоспалительных препаратов, антибиотиков, препаратов золота);
хронических, длительно протекающих бактериальных инфекциях (туберкулез, бруцеллез).
Изменение числа эозонофилов. Увеличение числа эозинофилов (эозинофилия) наблюдается при:
аллергических заболеваниях;
бронхиальной астме;
паразитарных заболеваниях;
инфекционных заболеваниях;
в период выздоровления после инфекционного заболевания «алая заря выздоровления»;
глистных инвазиях;
опухолях;
лимфогрануломатозе;
остром лейкозе;
хроническом миелолейкозе;
приеме лекарственных препаратов (антибиотики).
Снижение числа эозинофилов (эозинопения) наблюдается при:
воздействии гормонов надпочечников и АКТГ;
реакции на разного рода стрессы: (острые инфекции, сепсис, травмы, ожоги, хирургические вмешательства, физическое перенапряжение).
Появление эозинофилов в крови в этих случаях является благоприятным прогностическим признаком.
Изменение числа базофилов. Увеличение количества базофилов (базофилия) наблюдается при:
аллергических состояниях;
остром лейкозе;
хронических миелопролиферативных синдромах (хронический миелоидный лейкоз, миелофиброз, эритремия);
хронических воспалительных состояниях желудочно-кишечного тракта;
гипофункции щитовидной железы;
лечении эстрогенами.
Снижение числа базофилов (базопения) наблюдается при: острых инфекциях;
гиперфункции щитовидной железы; стрессе.
Изменение числа лимфоцитов. Увеличение числа лимфоцитов (лимфоцитоз). Увеличение абсолютного числа лимфоцитов.
1. Реактивные лимфоцитозы с обычными лимфоцитами: вирусная инфекция (грипп); острый инфекционный лимфоцитоз; коклюш.
2. Реактивные лимфоцитозы с реактивными лимфоцитами:
вирусная инфекция (аденовирус);
инфекционный мононуклеоз;
острый вирусный гепатит;
цитомегаловирус;
3. Гиперпластические заболевания лимфатической системы: хронический лимфатический лейкоз; макроглобулинемия Вальденстрема.
II. Относительный лимфоцитоз с реактивными лимфоцитами:
токсоплазмоз;
вирусные заболевания (корь, краснуха, паротит, ветрянка);
иммунологические заболевания;
туберкулез, сифилис, малярия, бруцеллез, дифтерия.
III. Относительный лимфоцитоз без реактивных лимфоцитов: нейтропении.
Уменьшение числа лимфоцитов (лимфопения) наблюдается при:
панцитопении;
приеме кортикостероидов;
тяжелых вирусных заболеваниях;
злокачественных новообразованиях;
почечной недостаточности;
недостаточности кровообращения.
Изменение числа моноцитов. Увеличение числа моноцитов (моноцитоз) наблюдается при:
бактериальных инфекциях (туберкулез, сифилис, бруцеллез, эндокардит);
в период выздоровления после острых состояний;
заболеваниях, вызванных простейшими;
воспалительных реакциях;
хирургических вмешательствах;
коллагенозах;
лейкозах (моноцитарный, миеломоноцитарный).
Снижение числа моноцитов (моноцитопения) наблюдается при: инфекциях с нейтропенией; после лечения глюкокортикостероидами.
Наследственные аномалии лейкоцитов
Пельгеровская аномалия (пельгеровский семейный вариант лейкоцитов) — это изменение крови, наследуемое по доминантному типу, при котором нарушается процесс сегментации ядер нейтрофильных лейкоцитов. Форма лейкоцита остается юной, похожей на метамиелоцит, а ядро уже «старое», созревшее. Структура ядер пельгеровских лейкоцитов грубоглыбчатая, пикнотическая. Большинство пельгеровских нейтрофилов имеет однодолевое, несегментированное ядро, по форме сходное с палочкоядерными клетками, что приводит к лабораторным ошибкам и гипердиагностике палочкоядерного сдвига. Ядро пельгеровских лейкоцитов может быть в виде эллипса, окружности, боба или почки, но короче, чем у обычных нейтрофилов. Реже встречаются ядра с намечающейся перетяжкой посередине, напоминающие по форме гимнастическую гирю или земляной орех. В базофилах, эозинофилах, моноцитах и лимфоцитах описанные выше изменения при пельгеровской аномалии встречаются реже и менее выражены. По способности к фагоцитозу, содержанию ферментов, длительности жизни пельгеровские нейтрофилы не отличаются от нормальных зрелых нейтрофилов.
Изменения нейтрофилов, сходные с пельгеровской аномалией, могут возникнуть и как вторичное явление (псевдопельгеровская аномалия) при некоторых заболеваниях — острые кишечные инфекции, агранулоцитоз, лейкозы. Такие изменения носят временный, преходящий характер. После выздоровления больного эти изменения лейкоцитов исчезают. Для уточнения диагноза пельгеровской аномалии необходимо исследовать кровь родителей пациента, что позволит избежать гипердиагностики сдвига лейкоцитарной формулы влево.
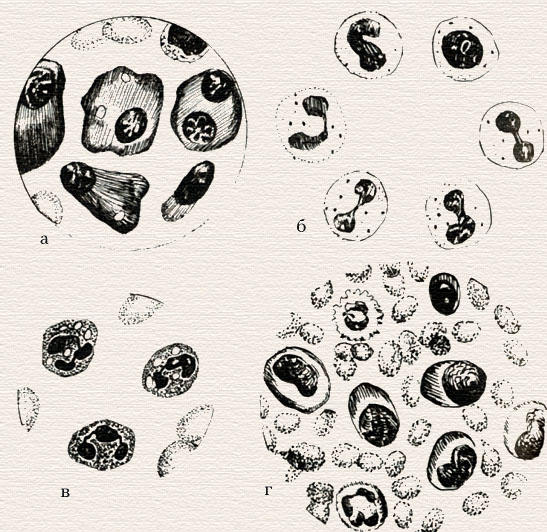
Варианты патологических изменений лейкоцитов в крови: а) костный мозг при миеломной болезни; б) пельгеровская аномалия; в) токсическая зернистость в нейтрофилах; г) картина крови при инфекционном мононуклеозе.
Асегментация ядер гранулоцитов, вариант Штодмейстера (Кассирский И. А., Алексеев П. И., 1970). В отличие от типично пельгеровских круглоядерных нейтрофилов с грубоглыбчатой, фрагментированной структурой и четкими контурами ядер, ядра клеток Штодмейстера характеризуются менее выраженной конденсацией хроматина и своеобразной бахромчатостью, состоящей из нежных хроматиновых нитей, как бы выступающих из основного ядерного массива в цитоплазму клетки Штодмейстера — вполне зрелые формы нейтрофильного ряда.
Врожденная сегментация ядер нейтрофилов (Кост Е. А., 1975). В этом случае преобладают нейтрофилы с 4 и более сегментами ядер. Морфологическая картина напоминает гиперсегментацию нейтрофилов при мегалобластных анемиях. Врожденная гиперсегментация ядер эозинофилов (Кост Е. А., 1975) (отмечается увеличение числа эозинофилов с 3-мя ядерными сегмнтами. Иногда выявляется и сегментация ядер моноцитов.
Цитохимические исследования лейкоцитов
Цитохимические исследования занимают важное место в дифференциальной диагностике гемобластозов. Кроме большого теоретического значения, неоспорима их роль в уточнении различных форм лейкозов. Цитохимические исследования проводят в мазках крови, лейкоконцентрата, костного мозга. Они основаны на использовании специфических химических цветных реакций для определения в клетках различных веществ. При цитохимическом исследовании пользуются полуколичественной оценкой результатов, применяя принцип G. Astaldi (1957), основанный на выявлении специфической окраски различной степени интенсивности. В зависимости от нее исследуемые элементы делят на 4 группы:
с отрицательной реакцией (–);
слабо положительной (+);
положительной (++);
резко положительной (+++).
Для количественного выражения результатов подсчитывают 100 клеток определенного вида и дифференцируют их по указанному принципу, затем число клеток с одинаковой интенсивностью окраски умножают на соответствующее данной группе число плюсов, сумма этих произведений составляет условные единицы (ед.). Активность ферментов выражают в условных единицах или в виде среднего цитохимического коэффициента (СЦК). Средний цитохимический коэффициент вычисляют по формуле Кеплоу в модификации Астальди и Верга: СЦК = (1а + 2б + 3в + 4г)/100, где цифры 1, 2, 3, 4 обозначают интенсивность окраски;
буквы а, б, в, г — число подсчитанных клеток с определенной интенсивностью окраски.
Метод полуколичественной оценки является ориентировочным, но позволяет сравнить распределение исследуемых веществ в различных клеточных элементах или в одних и тех же клетках при тех или иных патологических состояниях. Следует, однако, иметь в виду, что цитохимический метод может быть использован только в качестве дополнения к другим методам исследования — морфологическим, иммунологическим, цитогенетическим. Наиболее распространены цитоэнзиматические исследования, дающие возможность выявить в клетках активность различных ферментов. Для этого чаще используют методы азосочетания, в которых специфический субстрат, взаимодействуя с ферментом, образует продукт реакции, который окрашивается солями диазония, по окраске судят о локализации фермента и его активности.
Исследование крови имеет особенно важное диагностическое значение в диагностике гемобластозов. При появлении лихорадки неясного генеза, геморрагического синдрома, увеличении печени, селезенки, лимфатических узлов, кожных поражений, слабости, боли в костях необходимо проведение общего клинического анализа крови. Гемобластозы представляют собой опухолевые заболевания кроветворной ткани. Их подразделяют на две большие группы — лейкозы и гематосаркомы. Лейкозы — опухоли из кроветворной ткани с первичной локализацией в костном мозге. Опухолевые клетки легко выходят в периферическую кровь, давая характерную гематологическую картину.
Гематосаркомы — опухоли из кроветворной ткани с первичной внекостномозговой локализацией и выраженным местным опухолевым ростом. Лейкозы и гематосаркомы связаны между собой генетическим родством клеток, из которых они происходят, и могут переходить друг в друга. Лейкозы традиционно делят на острые и хронические, понимая под этим не особенности течения заболевания, а цитологическую характеристику субстрата опухоли. Морфологический субстрат острого лейкоза составляют бластные клетки I–IV-ого класса. Основная масса опухоли при хроническом лейкозе представлена зрелыми и созревающими клетками.
Этиология. Причины гемобластозов окончательно не ясны. Установлен ряд факторов, влияющих на частоту заболевания гемобластозами:
Радиационный фактор: ионизирующая радиация в атмосфере, облучение по поводу различных заболеваний, применение радиоктивных изотопов.
Химический фактор: более 3000 химических веществ вызывают повреждение клетки, приводя ее к опухолевому перерождению, 700 из них — лекарственные препараты (цитостатики, антибиотики, жаропонижающие, средства дезинфекции).
Наследственные хронические дефекты.
Обменные нарушения: изменение обмена триптофана (лейкозогенное действие метаболитов триптофана).
Инфекционно-вирусный фактор (вирус Эпштейна-Барра).
Патогенез. Предполагается, что этиологический фактор повреждает ДНК кроветворной клетки, нарушает генетический код и приводит к безостановочному размножению и нарушению дифференциации той или иной разновидности клеток. В соответствии с этим представлением в настояще время общепризнанной является клоновая теория патогенеза гемобластозов. Лейкозные клетки представляют собой клон, потомство одной мутировавшей клетки. В 1976 году группа французских, американских и английских гематологов (ФАБ-группа) разработала классификацию острых лейкозов и миелодиспластического синдрома.
Классификация лейкозов и миелодиспластического синдрома
В 1976 году группа французских, американских и английских гематологов (ФАБ-группа) разработала классификацию острых лейкозов и миелодиспластического синдрома.
Острые лейкозы. ФАБ-классификация острых нелимфобластных (миелоидных) лейкозов (М-лейкозы).
М0 — низкодифференцированный миелобластный;
М1 — острый миелобластный лейкоз без созревания (наряду с бластами не более 3–5 % промежуточных форм — промиелоциты, миелоциты);
М2 острый миелобластный лейкоз с созреванием, т. е. промежуточных форм — 10–15 %;
М3 — острый промиелоцитарный лейкоз;
М3V — острый промиелоцитарный гипогранулярный вариант;
М4 — острый миеломонобластный лейкоз;
М5а — острый монобластный без созревания;
М5b — острый монобластный с созреванием;
М6 — острый эритромиелоз;
М7 — острый мегакариобластный лейкоз.
Иммунологический фенотип острого лимфобластного лейкоза (Л-лейкозы).
В-клеточный: ранний пре-В-ОЛЛ; пре-В-ОЛЛ; промежуточный В-ОЛЛ; зрелый В-ОЛЛ.
Т-клеточный: ранний Т-ОЛЛ; промежуточный Т-ОЛЛ; зрелый Т-ОЛЛ.
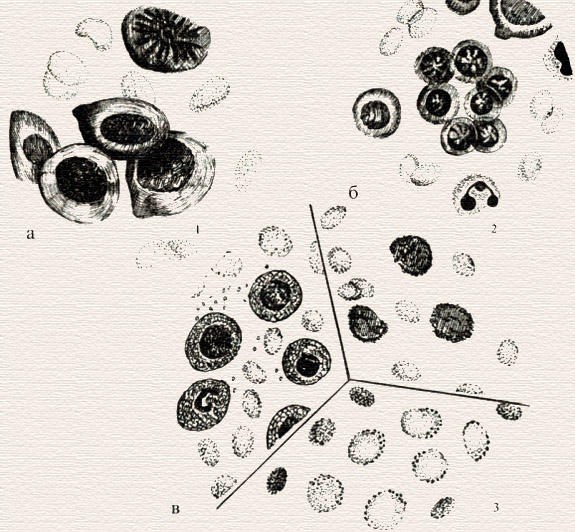
Варианты изменения лейкоцитов: а) мегалобласты в костном мозге при пернициозной анемии; б) пунктат костного мозга при гемолитической анемии (преобладают базофильные и полихроматофильные нормоцины); в) некоторые цитохимические реакции при острых лейкозах: 1) миелопероксиаза; 2) PAS-положительный материал; 3) хлорацетатэстераза.
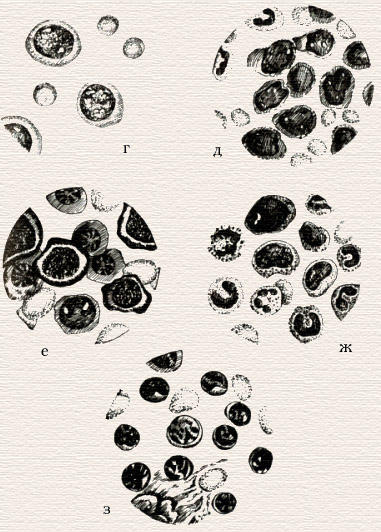
Варианты изменения лейкоцитов: г) острый лимфобластный лейкоз; д) острый миелобластный лейкоз; е) картина костномозгового пунктата при эритромиелозе. В поле зрения эритробласты, нормобласты, недифференцируемый бласт; ж) картина крови при хроническом миелолейкозе. В поле зрения нейтрофильны промиелоцит, миелоциты, метамиелоциты, палочкоядерный нейтрофил, сегментоядерные нейтрофилы, эозинофило; з) пунктат костного мозга при хроническом лимфолейкозе.
Хронические лейкозы:
Хронический миелолейкоз (взрослых, стариков, ювенильный, детская форма).
Сублейкемический миелоз.
Эритремия.
Хронический мегакариоцитарный.
Неклассифицируемые сублейкемические миелозы (вариант с высоким процентом базофилов).
Хронический эритромиелоз.
Хронический моноцитарный.
Хронический макрофагальный.
Хронический тучноклеточный.
Хроничесий лимфолейкоз (доброкачественный, классический, спленомегалическая форма, костномозговая форма, пролимфоцитарная форма, волосато-клеточный лейкоз.
Болезнь Сезари.
Парапротеинемические гемобластозы:
макроглобулинемия Вальденстрема;
миеломная болезнь;
болезни тяжелых цепей;
болезни легких цепей.
Внекостномозговые опухоли — лимфомы.
Лимфогрануломатоз (болезнь Ходжкина).
Неходжкинские лимфомы: лимфосаркомы — опухоли из клеток лимфатического ряда; лимфоцитомы — опухоли, состоящие из зрелых лимфоцитов.
В своем развитии лейкоз проходит 3 стадии:
1. Начальная (предлейкоз) — может быть оценена только ретроспективно.
2. Развернутая — с клиническими и гематологическими проявлениями болезни. Степень клинических проявлений обусловлена угнетением кроветворения. Все клинические проявления объединяются в 5 групп синдромов:
синдром опухолевой интоксикации: повышение температуры тела, слабость, потливость, снижение массы тела;
синдром лейкемической пролиферации: боли в костях, тяжесть и боли в левом и правом подреберьях, увеличение лимфатических узлов;
инфекционно-токсический синдром: проявляются инфекции в тех тканях, которые контактируют с внешней средой — ангины, стоматиты, ларингиты, конъюнктивиты, гастриты, проктиты, уретриты, кольпиты;
анемический синдром: слабость, головокружения, одышка при физической нагрузке;
геморрагический синдром: кожные геморрагии, кровоточивость десен, носовые кровотечения.
3. Терминальная — отсутствие эффекта от цитостатической терапии, угнетение кроветворения. Как любая опухоль, гемобластоз может быть установлен по обнаружению специфических для него клеток. Лейкозные клетки отличаются от нормальных рядом морфологичесих, химических, цитогенетических особенностей, свидетельствующих об их опухолевой природе.
Характеристика бластов
Бластные клетки отличает полиморфизм (микрогенерации, макрогенерации);
изменение формы ядра и цитоплазмы;
вакуолизация ядра и цитоплазмы;
нежный, сетчатый хроматин ядра;
базофилия цитоплазмы на всем протяжении;
увеличение числа нуклеол (до 8 и более), размер их может достигать 1/3 — 1/2 диаметра ядра;
резко выраженная зернистость в цитоплазме. Наличие палочек Ауэра — это соединенные в линейную структуру азурофильные гранулы.
Картина периферической крови при острых лейкозах. При острых лейкозах отмечается нарушение процессов кроветворения, что приводит к развитию анемии, тромбоцитопении, а при прогрессировании заболевания — бластемии. В раннем периоде острого лейкоза (особенно при остром лимфобластном лейкозе) анемии может не быть, позднее она достигает высоких степеней (содержание гемоглобина снижается до 30–60 Г/Л, количество эритроцитов — до 1,0–1,512/Л) и носит нормохромный или гиперхромный характер. При развитии геморрагического диатеза анемия может принять гипохромный характер (постгеморрагическая железодефицитная анемия). Количество ретикулоцитов обычно в пределах нормы. При остром эритромиелозе или болезни Ди Гульельмо (вариант М6 по FAB-классификации) ретикулоцитов обычно не более 10–30 % (Воробьев А. И., 1985). Морфология эритроцитов характеризуется макроанизоцитозом.
Другим характерным признаком острого лейкоза является тромбоцитопения (часто менее 20 х 109Г/Л). При остром лимфобластном лейкозе в начале заболевания количество тромбоцитов нередко нормальное, при прогрессировании заболевания уменьшается, в период ремиссии вновь увеличивается. Выраженная тромбоцитопения более характерна для миелоидных лейкозов. При остром мегакариобластном лейкозе (вариант М7 по FAB-классификации) уровень тромбоцитов, как правило, превышает нормальный, достигая 1 000–1 500 х 109/Л и более (Воробьев А. И., 1985).
Количество лейкоцитов может быть различным — повышенным при лейкемической, сублейкемических формах острого лейкоза; пониженным при лейкопенической форме. Содержание лейкоцитов редко достигает 100,0–300 х 109/Л. Лейкопенические формы составляют 40–50 % всех случаев острых лейкозов (Козловская Л. В., 1985) и более характерны для миелоидных форм острых лейкозов. Количество лейкоцитов может уменьшаться до 0,1–0,3 х 109/Л.
В типичных случаях в периферической крови обнаруживаются анаплазированные бласты. Нередко в формуле крови обнаруживают 95–99 % бластов, и только 1–5 % приходится на зрелые лейкоциты (продукция сохраненных очагов нормального кроветворения). Для острого лейкоза харатерно лейкемическое зияние: между клетками, составляющими морфологический субстрат болезни, и зрелыми лейкоцитами нет переходов «hiatus leukemicus».
При отсутствии бластов в периферической крови выделяют алейкемическую форму острого лейкоза. Диагностика алейкемических форм острого лейкоза затруднена, т. к. морфологическая картина крови напоминает картину крови при апластической анемии (анемия, лейкопения, тромбоцитопения, относительный лимфоцитоз). В этих случаях может помочь исследование крови методом лейкоконцентрации, позволяющее просмотреть большее число лейкоцитов, среди которых порой выявляют 5–10 % бластов (Козловская И. В., 1975).
Бластные клетки при остром лейкозе, несмотря на опухолевую природу, сохраняют морфологическое и цитохимическое сходство. Выделяют морфологические особенности бластных клеток при острых лейкозах. При острых миелобластных лейкозах бластные клетки имеют средние размеры, правильную форму, ядерно-цитоплазматическое отношение сдвинуто в пользу ядра нежной структуры с несколькими нуклеолами, цитоплазма голубая, часто содержит азурофильную зернистость и тельца Ауэра.
При острых лимфобластных лейкозах бластные клетки средних и маленьких размеров, правильной формы, ядерно-цитоплазматическое отношени высокое, ядро довольно компактное, с одной, реже двумя нуклеолами, цитоплазма базофильная, без зернистости. При острых монобластных лейкозах бластные клетки чаще крупных размеров, обычно неправильной формы, ядерно-цитоплазматическое отношение невысокое, ядро нежного хроматинового строения с бледными нуклеолами, цитоплазма слабо-базофильна, нередко вакуолизирована, чаще без включений. Уточнение форм острых лейкозов стало возможным благодаря цитохимичесим методам исследования.
Хронический миелолейкоз — заболевание кроветворной системы, при котором поражается клетка-предшественница миелопоэза. Этиология: в 85 % случаев происходит изменение хромосомного набора — появляется так называемая филадельфийская хромосома (Ph+).
Клиническая картина. 1. Миелопролиферативный синдром:
общие симптомы, вызванные интоксикацией, разрастанием лейкозных клеток в костном мозге, селезенке, печени (потливость, слабость, снижение массы тела);
увеличение печени и селезенки;
лейкемические инфильтраты в коже;
характерные изменения в костном мозге и периферической крови.
2. Синдром, обусловленный осложнениями: геморрагический диатез; гнойно-воспалительные осложнения; мочекислый диатез (гиперурикемия вследствие повышенного распада гранулоцитов.
Картина периферической крови зависит от стадии заболевания. Хронический миелолейкоз редко диагностируется в начальной стадии, когда количество лейкоцитов увеличено незначительно (20,0 — 30,0 х 10 Г/л). Чаще больные обращаются к врачу в связи с ухудшением самочувствия, появлением интоксикационного синдрома. Число лейкоцитов при этом достигает 200,0–300,0 х 10 Г/л.
В лейкограмме отмечается большое количество нейтрофильных гранулоцитов, нет лейкемического провала. На начальных этапах заболевания отмечается нейтрофильный лейкоцитоз со сдвигом влево, сдвиг до миелоцитов и промиелоцитов. Важным диагностическим признаком является увеличение эозинофильно-базофильной ассоциации, что говорит об утяжелении состояния больного (увеличение эозинофилов и базофилов до 20 %).
Содержание эритроцитов и гемоглобина — без существенных отклонений от нормы. В начальный стадии наблюдается тромбоцитоз. В развернутую стадию заболевания отмечается нарастание лейкоцитоза. В лейкоцитарной формуле сохраняется сдвиг до миелоцитов, промиелоцитов, нарастает содержание бластов — до 12 %, увеличивается эозинофильно-базофильная ассоциация. Отмечается снижение содержания гемоглобина и эритроцитов.
В терминальную стадию развивается тромбоцитопения. В крови — анемия, лейкопения. В лейкоцитарной формуле уменьшается процент сегментоядерных и палочкоядерных нейтрофилов, увеличивается процент незрелых базофилов и эозинофилов до 40–80 % (Бейер В. А., 1973), миелоцитов, промиелоцитов и бластных клеток. В терминальной стадии может развиться бластный криз (увеличение доли бластов и промиелоцитов более чем на 20 %).
Хронический лимфолейкоз — это заболевание кроветворной системы, при котором субстратом опухоли являются зрелые лимфоциты. Этиология. В 95 % случаев субстратом опухоли являются В-лимфоциты, а в 5 % — Т-лимфоциты. В клинической картине выделяют два синдрома: 1. Лимфопролиферативный, обусловленный лимфаденопатией, спленомегалией и лимфоидной пролиферацией костного мозга:
кожный зуд, лихорадка, потливость, боли в костях, селезенке, печени;
увеличение селезенки, печени;
лейкемические инфильтраты в коже;
симптомы, связанные с увеличением регионарных лимфатических узлов (медиастенальных, мезентериальных);
характерные изменения в костном мозге и периферической крови.
2. Синдром осложнений: гнойно-воспалительных; аутоиммунных (аутоиммунная гемолитическая анемия).
В клиническом анализе крови в начальную стадию отмечается умеренный лейкоцитоз (до 20,0–30,0 х 10 Г/л), абсолютный лимфоцитоз (более: 50–10,0 х 10 Г/л), тельца Гумпрехта (Воробьев А. И., 1985). Развернутая стадия заболевания характеризуется нарастающим лейкоцитозом до 300,0 х 10 Г/л и более. При подсчете лейкоцитарной формулы содержание лимфоидных элементов достигает 90–96 %, в том числе — 10–20 % телец Гумпрехта (клетки цитолиза). Среди лимфоцитов преобладают зрелые формы, пролимфоцитов и лимфобластов не более 2–3 %.
Эритремия (болезнь Вакеза) — доброкачественно текущий лейкоз, характеризующийся тотальной гиперплазией клеточных элементов костного мозга, особенно эритроцитарного ростка. Клиническая картина. Эритремия проявляется двумя большими синдромами: 1. Плеторический синдром обусловлен увеличением содержания эритроцитов, лейкоцитов, тромбоцитов:
головные боли, стенокардические боли, кожный зуд;
изменение окраски кожных покровов по типу эритроцианоза, повышение артериального давления, нарушение кровообращения в артериальной системе (тромбозы), приводящие к инфаркту миокарда, инсультам, нарушению зрения;
сдвиги в лабораторных показателях при клиническом анализе крови: увеличение содержания гемоглобина и эритроцитов, повышение показателя гематокрита и вязкости крови, умеренный лейкоцитоз со сдвигом влево, тромбоцитоз, резкое замедление СОЭ.
2. Миелопролиферативный синдром обусловлен гиперплазией всех трех ростков кроветворения:
слабость, потливость, повышение температуры тела, боли в костях;
увеличение селезенки, что объясняется не только миелоидной метаплазией органа, но и застоем в ней крови; реже наблюдается увеличением печени.
Метод трепанобиопсии кости позволяет выявить типичное для этого заболевания уменьшение жировой ткани, гиперплазию всех трех ростков (панмиелоз), значительное увеличение размера мегакариоцитов и повышенную отшнуровку пластинок. В конечной стадии заболевания развивается вторичный миелофиброз или — в результате опухолевой прогрессии — бластный криз (чаще по типу острого миелобластного лейкоза).
Миелома (плазмоцитома) — злокачественная опухоль, которая относится к группе парапротеинемических гемобластозов. Субстратом миеломы являются В-лимфоциты, которые дифференцируются до плазмоцитарных элементов и секретируют парапротеины. Паропротеины — это патологические иммуноглобулины. Клинические проявления:
общие симптомы (слабость, потливость);
симпотомы со стороны костной ткани: оссальгии, переломы (выделяются остеолитические вещества, которые вымывают кальций из костей);
поражение ткани почек: в почках постоянно фильтруются обломки парапротеинов (белок Бенс-Джонса). При взаимодействии белка Бенс-Джонса с полисахаридами образуется амилоид, который сдавливает нефрон. Развиватся хроническая почечная недостаточность;
развивается амилоидоз печени, амилоидоз сосудов (синдром Рейно).
При плазмоцитоме изменения лейкоцитарной формулы непостоянны. Они могут либо отсутствовать, либо характеризоваться умеренным лимфоцитозом, моноцитозом. При плазмоцитоме в мазках крови может быть небольшое количество плазматических клеток, значительное увеличение их наблюдается при трансформации миеломы в острый плазмобластный лейкоз, что наблюдается редко. В начальной стадии болезни изменения крови могут отсутствовать, но с генерализацией процесса развивается прогрессирующая анемия нормохромного типа. Иногда этот симптом является начальным в клинической картине болезни. Другой классический симптом — резкое и стабильное увеличение СОЭ до 80–90 мм/час. Диагноз подтверждается обнаружением высокой парапротеинемии, сопровождающейся снижением нормальных иммуноглобулинов, протеинкурии Бенс-Джонса.
Лейкемоидными реакциями называют изменения крови, наблюдающиеся иногда при ряде заболеваний и характеризующиеся появлением в периферической крови изменений, напоминающих лейкозы. Эти изменения носят реактивный характер и никогда не переходят в ту опухоль, которую напоминают. Отличия лейкемоидных реакций от лейкозов заключаются в следующем:
При лейкемоидных реакциях в большинстве случаев удается найти этиологический агент, вызвавший реакцию.
Изменения крови при лейкемоидных реакциях, как правило, нестойкие и подвергаются обратному развитию после ликвидации вызвавшего их патологического процесса.
Существенные отличия обнаруживаются при изучении пунктата костного мозга: лейкемоидные реакции миелоидного типа. В костном мозге увеличивается содержание молодых клеток нейтрофильного ряда. При лейкемоидной реакции преобладают более зрелые формы нейтрофилов (миелоциты, метамиелоциты). При обострении же хронического миелолейкоза отмечается преобладание ранних генераций нейтрофилов. Эозинофильно-базофильная ассоциация, часто наблюдаемая при хроническом миелолейкозе, равно как и филадельфийская хромосома, обычно выявляемые при этом заболевании, при лейкемоидной реакции отсутствуют; лейкемоидные реакции эозинофильного типа. Исследование костного мозга при лейкемоидных реакциях эозинофильного типа способствует дифференциальной диагностике с эозинофильным вариантом хронического миелоза и с острыми эозинофильными лейкозами.
Стерильный пунктат при лейкемоидной реакции эозинофильного типа характеризуется наличием более зрелых, чем при лейкозах, эозинофильных клеток и отсутствием уродливых форм эозинофилов, встречающихся при лейкозах.
Лейкемоидные реакции миелоидного типа никогда не сопровождаются базофилией.
При лейкемоидных реакциях все клетки нормальные, при лейкозах — атипичные.
При лейкемоидных реакциях не страдают другие ростки кроветворения, при лейкозах страдают все ростки кроветворения.
При определенных формах лейкемоидных реакций в дифференциальной диагностике с лейкозами играют роль некоторые специальные методы исследования крови. Так, при лейкемоидной реакции миелоидного типа повышается активнось щелочной фосфатазы в нейтрофилах, в то время как для большинства случаев хронического миелолейкоза характерна низкая активность щелочной фосфатазы, нейтрофилов; следует отметить, что при сублейкемическом миелозе щелочная фосфатаза в нейтрофилах может присутствовать.
Классификация лейкемоидных реакций: Гранулоцитарные: нейтрофильные; эозинофильные. Лимфоцитарные. Моноцитарные.
Лейкемоидные реакции миелоидного типа могут развиваться при туберкулезе, метастазах рака в костный мозг, при сепсисе, крупозной пневмонии, дифтерии, скарлатине, хронической и острой лучевой болезни. Лейкемоидные реакции эозинофильного типа чаще развиваются при глистных инвазиях, могут возникать при бронхиальной астме и коллагенозах, эозинофильные реакции могут сопровождать злокачественные опухоли. Лейкемоидные реакции лимфатического типа могут встречаться в некоторых случаях при краснухе, коклюше, ветряной оспе, инфекционном лимфоцитозе и инфекционном мононуклеозе.
Инфекционный мононуклеоз — острое заболевание вирусной природы, встречающееся у детей и лиц более старшего востраста (обычно до 40 лет). Периоды развития: Инкубационный период — 2–3 недели. Период развития проявлений — 2–3 дня. Период разгара — от — 2–3 недель до 2 месяцев. Клинические проявленния:
высокая лихорадка неправильного типа;
характерна ангина;
лимфаденопатия; лимфоузлы неспаянные, болезненные;
спленомегалия;
тяжелый астенический синдром;
геморрагические высыпания на коже.
Лабораторная диагностика. Лейкоцитоз в начальный период в норме. В период разгара количество лейкоцитов увеличивается до 40–80х10 Г/л. Лейкоцитоз обусловлен абсолютным лимфоцитозом с наличием атипичых (бласттрансформированных) лимфоцитов, имеющих характеристику Т- или одновременно Т- и В-клеток. В период выздоровления отмечается лейкопения, лимфоцитоз до 70%. Иногда отмечается небольшая тромбоцитопения, изменение СОЭ неспецифично.
Морфология атипичных мононуклеаров. В мазке преобладают мононуклеары трех основных типов: малые формы с ядрами, имеющими грубую хроматиновую сеть; клетки, сходные с плазматическими, и большие, трудно отличимые от лейкозных клетки с гомогенным нежным ядром, содержащим неотчетливо выраженные нуклеолы. Всем типам мононуклеаров свойственна вакуолизация цитоплазмы, полиморфизм формы и размера ядра. Характерным для инфекционного мононуклеоза является выявление высокого титра (выше 1:56) гетерофильных антител в агглютинационных тестах (реакция агглютинации сывороткой больного эритроцитов барана — Paul-Bunnel-тест, или лошади — Monospot-тест), а также параллельное повышение титра антител против вируса Эпштейна-Барра. Лейкемоидные реакции моноцитарного типа чаще встречаются при подострых и хронических бактериальных инфекциях, паразитарных инфекциях.
Тромбоциты — безъядерные клетки размером от 1 до 5 мкм — являются фрагментами цитоплазмы мегакариоцитов, имеют гиаломер и грануломер. Гиаломер тромбоцитов ограничен трехслойной мембраной, играющей большую роль в процессах адгезии и агрегации тромбоцитов. В гранулах содержатся фосфолипиды, АТФ, серотонин, ферменты, фибронектин, гистамин, катионные белки, фактор, активирующий фибробласты, трансформирмирующий ростовой фактор. Популяция тромбоцитов неоднородна. В ней различают зрелые тромбоциты (87,0±0,19%), юные (3,2±0,13%), старые (4,5±0,21%) и формы раздражения (2,5±0,1%). Время циркуляции тромбоцитов — 10–12 суток. Разрушение тромбоцитов происходит в селезенке.
Основные функции тромбоцитов:
ангиотрофическая (способность поддерживать нормальную структуру и функции стенок микрососудов);
адгезивно-агрегационная (способность образовывать в поврежденных сосудах первичную тромбоцитарную пробку);
способность поддерживать спазм поврежденных сосудов;
участие в свертывании крови и влияние на фибринолиз;
тромбоциты переносят на своей повехности циркулирующие иммунные комплексы.
Подсчет количества тромбоцитов. В практике при подсчете тромбоцитов используют методы, основанные на двух принципах: Непосредственный подсчет в крови (с помощью счетной камеры или счетчика). Подсчет в мазках крови на определенное количество эритроцитов с пересчетом на 1 мкл или 1 л с учетом общего количества эритроцитов в крови.
Каждая группа методов имеет преимущества и недостатки. Существенным преимуществом первой группы методов является их точность. Непосредственный подсчет тромбоцитов в крови удобен еще и потому, что не требует для расчета сведений о количестве эритроцитов, но подсчет в камере более трудоемкий, поскольку тромбоциты в нативном виде представлены мелкими и плохо контрастированными элементами. Недостатком этих методов является необходимость подсчета тромбоцитов в ближайшие часы после взятия крови. Подсчет тромбоцитов в мазках крови значительно уступает по своей точности методам непосредственного подсчета в камере или с помощью счетчиков или автоматов. Ошибки при подсчете в мазках крови могут быть обусловлены несколькими причинами: плохое качество мазка и связанное с этим неравномерное распределение тромбоцитов, неточный подсчет эритроцитов в крови. Существенное неудобство метода — необходимость одновременного подсчета тромбоцитов и эритроцитов в крови. Преимущество его — возможность подсчета тромбоцитов в любое время, независимо от момента взятия крови. В качестве унифицированных были утверждены два метода, основанные на обоих принципах.
Метод подсчета в камере. Принцип. Подсчет тромбоцитов в 1 мкл (или 1 л) с учетом разведения крови и объема квадрата счетной сетки с применением фазово-контрастного устройства для контрастирования тромбоцитов.
Реактивы. Применяют реактив 1 или 2.
Кокаина гидрохлорид — 3 г, натрия хлорид — 0,25 г, фурацилин — 0,025 г, дистиллированная вода — 100 мл.
1%-й раствор оксалата аммония. Раствор кипятят и фильтруют, хранят в холодильнике. Сравнительный анализ разных разводящих жидкостей позволил считать лучшим 15%-й раствор оксалата аммония, так как он дает быстрый и полный лизис эритроцитов.
Специальное оборудование.
Микроскоп.
Фазово-контрастное устройство.
Счетная камера Горяева.
Осветитель к микроскопу (ОИ-7, ОИ-18).
Ход определения. Разводят исследуемую кровь в 200 раз: для этого в сухую пробирку набирают 4 мл реактива 1 или 2 и 0,02 мл крови. Перемешивают и оставляют на 25–30 минут для гемолиза эритроцитов. Подготавливают счетную камеру. Перемешивают разведенную кровь и заполняют камеру, подносят каплю ее с помощью стеклянной палочки или пастеровской пипетки к краю покровного стекла, следя за тем, чтобы кровь равномерно, без пузырьков воздуха заполняла всю поверхность сетки, не затекая в бороздки. Помещают счетную камеру во влажную среду на 5 минут для оседания тромбоцитов (чашка Петри с уложенной по краям смоченной водой фильтровальной бумагой). Подготавливают фазово-контрастное устройство в соответствии с инструкцией, приложенной к нему. Производят подсчет тромбоцитов в 25 больших квадратах.
Тромбоциты выглядят в счетной камере в виде мелких, хорошо преломляющих свет образований. Расчет числа тромбоцитов проводят, исходя из разведения крови (200), числа сосчитанных квадратов (25) и объема одного боьшого квадрата (1/250 мкл, так как сторона квадрата 1/5 мм, высота 1/10 мм).
Х = (а х 250 х 200)/25 = а х 2000, где Х — число тромбоцитов в 1 мкл крови; а — число тромбоцитов, сосчитанных в 25 больших квадратах.
Метод подсчета в мазках крови (по Фонио). Принцип. Метод основан на подсчете числа тромбоцитов в окрашенных мазках крови на 1000 эритроцитов с расчетом на 1 мкл (или 1 л) крови, исходя из содержания в этом объеме количества эритроцитов.
Реактивы. Применяют реактив 1 или 2.
14%-ный раствор сульфата магния.
6%-ный раствор этилендиаминтетраацетата натрия (ЭДТА).
Специальное оборудование. Микроскоп.
Ход определения. Смешивают кровь с реактивом 1 или 2; для этого взятый капилляром Панченкова реактив до метки «75» вносят в пробирку, затем добавляют кровь, взятую тем же капилляром до метки «0». Содержимое пробирки перемешивают и готовят тонкие мазки. Фильтруют и окрашивают по Романовскому-Гимзе в течение 2–3 часов (при использовании реактива 1) и в течение 40–45 минут (при использовании реактива 2). Высохшие мазки микроскопируют с иммерсионным объективом, подсчитывая количество тромбоцитов в тонких местах препарата (эритроциты должны быть расположены изолированно).
Подсчет производят следующим образом: в каждом поле зрения микроскопа считают число эритроцитов и тромбоцитов, передвигая мазок до тех пор, пока не будет просчитана 1000 эритроцитов. Для удобства счета и большей точности следует пользоваться специальным окуляром с уменьшенным полем зрения. При отсутствии готового окуляра его можно легко приготовить, для чего отвинчивают окуляр 7х, вкладывают в него кусок бумаги с вырезанным небольшим квадратиком и завинчивают. Параллельно берут кровь для подсчета эритроцитов в камере Горяева.
Расчет: количество тромбоцитов на 1000 эритроцитов составляет А%. Зная число эритроцитов в 1 мкл (или 1 л) крови, легко подсчитать количество тромбоцитов в 1 мкл крови (в 1 л). Например: А = 60%, число эритроцитов 5 х 106/мкм
Составляют пропорцию: 60 — 1000, х — 5 000 000, откуда: Х = (60 х 5 000 000)/1 000 = 300 х 1 000 мкл
(300 х 103/мкм или 300 х 109/л).
Подсчет числа тромбоцитов в гематологическом анализаторе. Применение гематологических анализаторов существенно повышат точность и скорость подсчета тромбоцитов в крови. Принцип работы большинства счетчиков основан на кондуктометрическом методе. Ход исследования изложен в инструкции по работе, прилагаемой к конкретному прибору.
Нормальные величины. Количество тромбоцитов у здоровых людей составляет 180–320 х 10 Г/л (Воробьев А.И.,1985); 200 — 400 х 10 Г/л (Бейер В. А., 1973, Кост Е. А.).
Клиническое значение. Снижение количества тромбоцитов (тромбоцитопения) может развиваться в результате снижения продукции тромбоцитов (опухолевые заболевания — острые лейкозы, миелодиспластический синдром, миелофиброз, метастазы рака в костный мозг, мегалобластные анемии, ночная пароксизмальная гемоглобинурия, после вирусных инфекций, интоксикаций, наследственные аномалии); в результате повышения деструкции тромбоцитов (идиопатическая тромбоцитопеническая пурпура, системная красная волчанка, хронический лимфолейкоз, хронический активный гепатит, посттрансфузионная тромбоцитопения); разрушения в селезенке (гиперспленизм при болезнях накопления, лимфомах, волосатоклеточном лейкозе, миелопролиферативных заболеваниях, портальной гипертензии). Повышение количества тромбоцитов (тромбоцитоз) характерно для миелопролиферативных заболеваний, наблюдается при злокачественных новообразованиях, после операций, при воспалительных заболеваниях (острый ревматизм, ревматоидный артрит, туберкулез, остеомиелит), после спленэктомии.
Совместно с Мегаэнциклопедией «Кирилла и Мефодия»
| официальный сайт © ООО «КМ онлайн», 1999-2025 | О проекте ·Все проекты ·Выходные данные ·Контакты ·Реклама | |||
|
|
Сетевое издание KM.RU. Свидетельство о регистрации Эл № ФС 77 – 41842. Мнения авторов опубликованных материалов могут не совпадать с позицией редакции. Мультипортал KM.RU: актуальные новости, авторские материалы, блоги и комментарии, фото- и видеорепортажи, почта, энциклопедии, погода, доллар, евро, рефераты, телепрограмма, развлечения. Подписывайтесь на наш Telegram-канал и будьте в курсе последних событий. |







Комментарии читателей Оставить комментарий